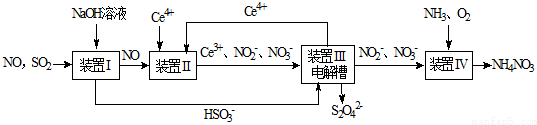
题目内容
12. 节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.
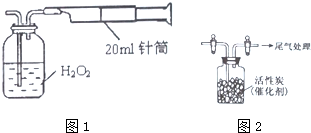
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.I.某实验小组同学拟用如图1所示简易装置测定空气中SO2的含量.
实验操作如下:按图连接好仪器,检查装置气密性后,
在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2S04).在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.233mg.
(1)计算所测空气中SO2含量为0.032mg•L-1.
(2)已知常温下BaS03的Ksp为5.48x10-7,饱和亚硫酸溶液中c(S032-)=6.3x10-8{mol•L-1.有同学认为以上实验不必用H2O2吸收SO2,直接用O.1mol•L-1BaCl2溶液来吸收S02即可产生沉淀.请用以上数据分析这样做是否可行c(Ba2+)×c(SO32-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,不会生成沉淀,不可以用氯化钡溶液吸收二氧化硫.
II.另一实验小组同学依据SO2具有还原性,推测SO2能被C12氧化生成SO2C12.用如图2所示装置收集满C12,再通入SO2,集气瓶中立即产生无色液体,充分反应后,将液体和剩余气体分离,进行如下研究.
(3)写出二氧化锰和浓盐酸反应制取氯气的离子方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)研究反应的产物.向所得液体中加水,出现白雾,振荡、静置得到无色溶液.经检验该溶液中的阴离子(除OH-外)只有S042-、C1-,证明无色液体是SO2C12.写出SO2C12与H2O反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
(5)研究反应进行的程度.用NaOH溶液吸收分离出的气体,用盐酸酸化后,再滴加BaCl2溶液.产生白色沉淀.
①该白色沉淀的成分是BaSO4.
②SO2和C12生成SO2C12的反应是可逆反应(填“是”或“不是”),阐述理由由于白色沉淀是BaSO4,所以反应后的混合气体中必然存在SO2和Cl2两种气体.因此SO2和Cl2生成SO2Cl2的反应为可逆反应.
分析 (1)根据S原子质量守恒,生成硫酸钡的物质的量就等于二氧化硫的物质的量,计算出空气中二氧化硫的含量;
(2)根据亚硫酸钡的溶度积,比较溶液中的c(Ba2+)×c(SO32-)乘积与KSP(BaSO3)大小关系,从而判断是否生成沉淀;
(3)二氧化锰和浓盐酸反应生成氯气、氯化锰和水;
(4)SO2Cl2与H2O反应生成硫酸和氯化氢;
(5)SO2和Cl2生成SO2Cl2的反应为可逆反应,SO2Cl2分解得到的氯气和二氧化硫在水溶液中发生氧化还原反应生成硫酸和氯化氢,硫酸与氯化钡反应生成硫酸钡沉淀.
解答 解:(1)白色沉淀是硫酸钡沉淀,物质的量是:$\frac{0.233×1{0}^{-3}g}{233g/mol}$=1×10-6mol,取样处空气中SO2含量为:$\frac{1×1{0}^{-6}mol×64×1{0}^{3}mg/mol}{0.02L×100}$=0.032mg/L,
故答案为:0.032;
(2)因溶液中c(Ba2+)=0.1mol/L,c(SO42-)≤6.3×10-8mol/L,其离子积c(Ba2+)×c(SO42-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,所以直接用直接用0.1mol/L BaCl2溶液来吸收SO2不能产生BaSO3沉淀,
故答案为:c(Ba2+)×c(SO32-)≤6.3×10-9mol/L<KSP(BaSO3)=5.48×10-7,不会生成沉淀,不可以用氯化钡溶液吸收二氧化硫;
(3)二氧化锰和浓盐酸反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)SO2Cl2与水反应的方程式SO2Cl2+2H2O=H2SO4+2HCl,故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
(5)①SO2和Cl2生成SO2Cl2的反应为可逆反应,SO2Cl2分解得到的氯气和二氧化硫在水溶液中发生氧化还原反应生成硫酸和氯化氢,硫酸与氯化钡反应生成硫酸钡沉淀,故答案为:BaSO4;
②SO2+Cl2?SO2 Cl2,由于白色沉淀是BaSO4,所以反应后的混合气体中必然存在SO2和Cl2两种气体,SO2和Cl2生成SO2Cl2的反应为可逆反应,
故答案为:是,由于白色沉淀是BaSO4,所以反应后的混合气体中必然存在SO2和Cl2两种气体.因此SO2和Cl2生成SO2Cl2的反应为可逆反应.
点评 本题为实验题,考查了二氧化硫的性质,题目难度中等,明确物质的性质是解题关键,注意离子检验的方法.

| A. | 多氯代甲烷中分子结构为正四面体的是CH2Cl2 | |
| B. | 氯代甲烷在常温下均为液体 | |
| C. | 乙烯可用于制取1,2-二氯乙烷和乙醇,前者为加成反应,后者为水解反应 | |
| D. | 麻醉剂三氟氯溴乙烷(CF3CHClBr)的同分异构体有3种(不考虑立体异构) |
| A. | 铁片镀锌时,铁片与外电源的正极相连 | |
| B. | 反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 0.1mol•L-1的CH3COOH溶液加水稀释,溶液的pH和其中水的电离程度均增大 | |
| D. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 |
| A. | 石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 | |
| B. | 做衣服的棉、麻、蚕丝的主要成分都是纤维素 | |
| C. | 鸡蛋清中加人胆矾可以使蛋白质发生聚沉.加水后重新溶解 | |
| D. | 乙烯和氯乙烯都可以通过加聚反应得到高分子化合物 |
| A. | 常温下NaF溶液的pH大于7 | |
| B. | HF能与Na2CO3溶液反应,产生CO2气体 | |
| C. | 1mol/L的HF水溶液能使紫色石蕊试液变红 | |
| D. | 用HF溶液做导电性实验,灯泡很暗 |
| A. | 碱性溶液:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
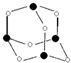 主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.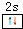 ,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.
,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.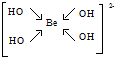 ,1mol该离子中含有的共价键数目为8NA.
,1mol该离子中含有的共价键数目为8NA.