题目内容
15.下列装置应用于实验室从废旧的含CuI/SiO2催化剂中提取碘的实验,不能达到实验目的是( )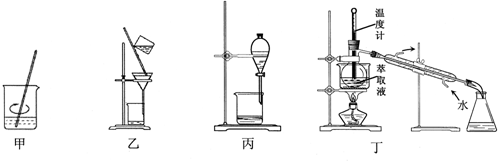
| A. | 用装置甲加稀H2SO4及H2O2氧化并用CCl4浸取 | |
| B. | 用装置乙过滤分离出浸取液 | |
| C. | 用装置丙分离得到碘的四氯化碳溶液 | |
| D. | 用装置丁分离萃取液中单质碘和四氯化碳 |
分析 A.实验室从废旧的含CuI/SiO2催化剂中提取碘,CuI具有还原性,应该用氧化性物质将碘离子氧化,然后加入萃取剂;
B.分离难溶性固体和溶液采用过滤方法;
C.碘在水的溶解度远远小于在四氯化碳中的溶解度,且四氯化碳和水不互溶,碘和四氯化碳不反应,可以采用萃取分液方法分离碘;
D.蒸馏时温度计测量馏分温度.
解答 解:A.实验室从废旧的含CuI/SiO2催化剂中提取碘,CuI具有还原性,应该用氧化性物质将碘离子氧化,且不能引进新的电子,然后加入萃取剂进行萃取,双氧水能将CuI氧化生成碘单质,符合条件,故A正确;
B.分离难溶性固体和溶液采用过滤方法,二氧化硅不溶于水,所以可以采用过滤方法分离浸取液,故B正确;
C.碘在水的溶解度远远小于在四氯化碳中的溶解度,且四氯化碳和水不互溶,碘和四氯化碳不反应,可以采用萃取分液方法分离碘,故C正确;
D.蒸馏时温度计测量馏分温度,温度计水银球应该位于支管口处,故D错误;
故选D.
点评 本题考查实验方案评价,为高频考点,明确实验原理是解本题关键,会根据物质的性质选取合适的分离提纯方法,易错选项是D.

练习册系列答案
相关题目
5. 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
(1)N2H4-空气燃料电池是一种碱性人类电池,属于环保型电池,产物无污染.电解质溶液是20%~30%的KOH溶液.则人类电池放电时:正极的电极反应式是O2+2H2O+4e-=4OH-;负极的电极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(2)在波兰沦陷时,波尔为了防止诺贝尔奖章落入敌人手中,用王水将奖章溶解.然后再讲黄金从王水中提取处理,重新铸成奖章.王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属.铂溶于王水时产生[PtCl4]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O;
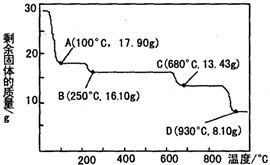
(3)硫酸锌被广泛应用于工农业生产和医药领域.取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示,在图中C点,680℃时所得固体的化学式为b(填字母序号).
a.ZnSO4•H2O b.Zn3O(SO4)2 c.ZnSO4 d.ZnO
(4)草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用.已知:
①(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”).
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)处理工业废水中的铁元素,一般做法都是使之完全转化成Fe3+,并转化成Fe(OH)3沉淀而除去.已知废水中c(Fe3+)=1.0×10-2mol•L-1,要想将其沉淀除去,则应调节溶液pH至少大于2.(已知常温下Fe(OH)3的Knp=1.0×10-38)
 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.(1)N2H4-空气燃料电池是一种碱性人类电池,属于环保型电池,产物无污染.电解质溶液是20%~30%的KOH溶液.则人类电池放电时:正极的电极反应式是O2+2H2O+4e-=4OH-;负极的电极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(2)在波兰沦陷时,波尔为了防止诺贝尔奖章落入敌人手中,用王水将奖章溶解.然后再讲黄金从王水中提取处理,重新铸成奖章.王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属.铂溶于王水时产生[PtCl4]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O;
(3)硫酸锌被广泛应用于工农业生产和医药领域.取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示,在图中C点,680℃时所得固体的化学式为b(填字母序号).
a.ZnSO4•H2O b.Zn3O(SO4)2 c.ZnSO4 d.ZnO
(4)草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用.已知:
| 电离方程式 | 电离常数 |
| H2C2O4?H++HC2O4- | K1=5.4×10-2 |
| HC2O4-?H++C2O42- | K2=5.4×10-5 |
| NH3•H2O?NH4++OH- | K=1.8×10-5 |
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)处理工业废水中的铁元素,一般做法都是使之完全转化成Fe3+,并转化成Fe(OH)3沉淀而除去.已知废水中c(Fe3+)=1.0×10-2mol•L-1,要想将其沉淀除去,则应调节溶液pH至少大于2.(已知常温下Fe(OH)3的Knp=1.0×10-38)
6.仅用下表提供的仪器(夹持仪器和试剂任选),不能实现相应实验目的是( )
| 选项 | 实验目的 | 仪器 |
| A | 从食盐水中获得NaCl晶体 | 蒸发皿、玻璃棒、酒精灯 |
| B | 用稀H2SO4、Na2CO3溶液比较元素S与C的非金属性强弱 | 试管、胶头滴管 |
| C | 用8.0mol.L-1的盐酸配制 250mL1.5mol.L-1的盐酸 | 250m容量瓶,玻璃棒、烧杯 |
| D | 测定NaOH溶液的物质的量浓度 | 酸(碱)式滴定管,胶头滴管、锥形瓶、烧杯 |
| A. | A | B. | B | C. | C | D. | D |
10.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 4.6克钠与水反应时失去的电子数目为0.2NA | |
| B. | 1 L0.5mol•L-1 Na2SO4溶液中所含有的Na+离子数日为NA | |
| C. | 在标准状况下,22.4LNH3所含的氨分子数目为NA | |
| D. | 常温常压下2克氢气所含原子数日为NA |
20.下列有关说法正确的是( )
| A. | 铁片镀锌时,铁片与外电源的正极相连 | |
| B. | 反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 0.1mol•L-1的CH3COOH溶液加水稀释,溶液的pH和其中水的电离程度均增大 | |
| D. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 |
7.下列说法正确的是( )
| A. | 石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 | |
| B. | 做衣服的棉、麻、蚕丝的主要成分都是纤维素 | |
| C. | 鸡蛋清中加人胆矾可以使蛋白质发生聚沉.加水后重新溶解 | |
| D. | 乙烯和氯乙烯都可以通过加聚反应得到高分子化合物 |
4.下列离子组在指定溶液中能大量共存的是( )
| A. | 碱性溶液:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
 主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子. ,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.
,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.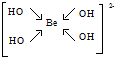 ,1mol该离子中含有的共价键数目为8NA.
,1mol该离子中含有的共价键数目为8NA.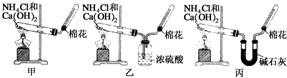 甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题: