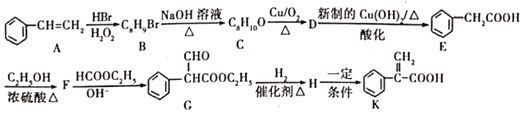
题目内容
【题目】人们运用元素周期律和元素周期表,可以系统研究元素的性质。试回答:
(1)碱金属元素中,锂原子的结构示意图为__、其中6Li、7Li互为__,用电子式表示Li2O的形成过程___。
(2)金属钾19K位于元素周期表中的第__周期、第__族;钾的氧化物有多种,其中过氧化钾(K2O2)和超氧化钾(KO2)常作供氧剂,写出过氧化钾与CO2反应的化学方程式:___;超氧化钾与水反应如下,请配平该反应的化学方程式:
_KO2+_H2O=_KOH+_O2↑+_H2O2
(3)第三周期元素中,酸性最强的HClO4中氯元素的化合价为__、可作半导体材料的元素是__(填名称),当反应H2+Cl2![]() 2HCl发生过程中,涉及到___键断裂和__键的形成。(填:离子键或极性键或非极性键)
2HCl发生过程中,涉及到___键断裂和__键的形成。(填:离子键或极性键或非极性键)
【答案】![]() 同位素
同位素 ![]() 四 ⅠA 2K2O2+2CO2=2K2CO3+O2 2 2 2 1 1 +7 硅 非极性键 极性键
四 ⅠA 2K2O2+2CO2=2K2CO3+O2 2 2 2 1 1 +7 硅 非极性键 极性键
【解析】
(1)碱金属元素中,锂原子为3号元素质子数相同中子数不同的同一元素不同原子互为同位素, Li2O是离子化合物;
(2)金属钾19K为19号元素,质子数为19,原子结构示意图为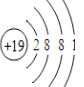 ,过氧化钾与CO2反应生成碳酸钠和氧气;根据氧化还原反应规律配平方程式;
,过氧化钾与CO2反应生成碳酸钠和氧气;根据氧化还原反应规律配平方程式;
(3)根据化合物中化合价为零,判断氯元素的化合价,根据化合物中化学键的类型判断化学键的断裂与形成。
(1)碱金属元素中,锂原子为3号元素,原子结构示意图为![]() ,质子数相同中子数不同的同一元素不同原子互为同位素,则6Li、7Li互为同位素,Li2O是离子化合物,其形成过程
,质子数相同中子数不同的同一元素不同原子互为同位素,则6Li、7Li互为同位素,Li2O是离子化合物,其形成过程![]() ;
;
(2)金属钾19K为19号元素,质子数为19,原子结构示意图为 ,位于元素周期表中的第四周期、第ⅠA族;过氧化钾与CO2反应生成碳酸钠和氧气,化学方程式为:2K2O2+2CO2=2K2CO3+O2;超氧化钾与水反应,根据氧化还原反应电子得失守恒及物料守恒,配平该反应的化学方程式:2KO2+2H2O=2KOH+O2↑+H2O2;
,位于元素周期表中的第四周期、第ⅠA族;过氧化钾与CO2反应生成碳酸钠和氧气,化学方程式为:2K2O2+2CO2=2K2CO3+O2;超氧化钾与水反应,根据氧化还原反应电子得失守恒及物料守恒,配平该反应的化学方程式:2KO2+2H2O=2KOH+O2↑+H2O2;
(3)酸性最强的HClO4,根据化合物化合价之和为零,则氯元素的化合价为+7,可作半导体材料的元素是硅;反应H2+Cl2![]() 2HCl中,H2和Cl2是同种元素形成的单质,只含有非极性共价键,HCl是不同元素组成的化合物,只含有极性共价键,化学反应的实质为旧键的断裂和新键的形成,因此,涉及到非极性键断裂和极性键的形成。
2HCl中,H2和Cl2是同种元素形成的单质,只含有非极性共价键,HCl是不同元素组成的化合物,只含有极性共价键,化学反应的实质为旧键的断裂和新键的形成,因此,涉及到非极性键断裂和极性键的形成。