题目内容
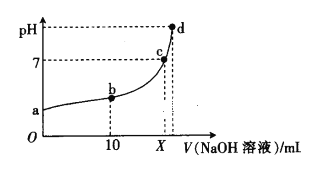
【题目】已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:

请回答:
(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
【答案】2Al+Fe2O3![]() 2Fe+Al2O3 还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN(或NH4SCN) 溶液变红(或呈现血红色)
2Fe+Al2O3 还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN(或NH4SCN) 溶液变红(或呈现血红色)
【解析】
氧化铁与铝单质在高温下发生铝热反应,生成A,则A为Fe,铁和水蒸气在高温下反应生成B,B为黑色磁性氧化物,则B为Fe3O4,Fe3O4中铁元素的化合价含有+2、+3价,与盐酸反应生成FeCl3和FeCl2,铁与过量盐酸反应生成FeCl2,则C为FeCl2,FeCl2与双氧水反应生成FeCl3,则D为FeCl3,据此分析解答。
(1)反应①称为铝热反应(属于置换反应),该反应的化学方程式:2Al+Fe2O3![]() 2Fe+Al2O3,反应中Al有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;
2Fe+Al2O3,反应中Al有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;
(2)反应④为FeCl2与双氧水反应生成FeCl3,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)C为FeCl2,D为FeCl3,亚铁离子具有还原性,易被氧化,新配制的FeCl2溶液中应加入铁粉(屑),以防止其转化为FeCl3。检验三价铁离子常用试剂是KSCN(或NH4SCN),三价铁离子遇SCN-变为血红色溶液。

【题目】查阅文献:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价氮的化合物。
Ⅱ.FeSO4 + NO![]() Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被酸性KMnO4溶液氧化吸收。
甲按照如图所示的实验装置进行实验:
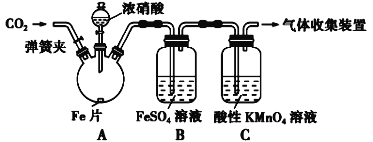
实验操作和现象记录如表所示:
实验操作 | 实验现象 |
打开弹簧夹,通入一段时间CO2,关闭弹簧夹 | |
打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞 | 无明显现象 |
加热烧瓶,反应开始后停止加热 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余 |
请回答下列问题:
① 加热前,向烧瓶中滴入浓硝酸没有明显现象的原因是________________________________
② 检验是否生成-3价氮的化合物,应进行的实验操作是________________________________
③ 甲取少量B中溶液,加热,实验现象是____________________________________________,请用化学平衡原理解释原因________________________________________________________,甲依据该现象得出结论:铁与硝酸反应有NO生成。
④乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是____________________________,证明有NO生成的实验现象是________________________________________________