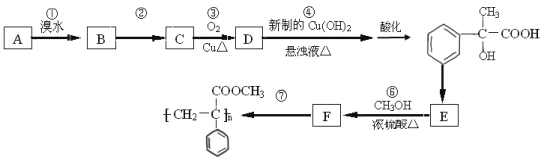
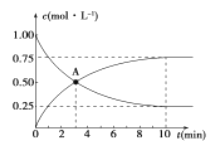
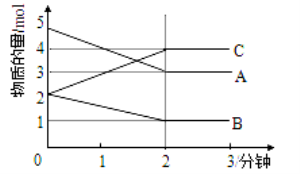
题目内容
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为_____________,G的原子结构示意图是__________________________。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为_________,所含化学键类型为___________,向甲中滴加足量水时发生反应的化学方程式是____________________________。
(3)E、F、G三种元素形成的简单离子,半径由大到小的顺序是__________。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则a极是该电池的________极,正极的电极反应式为____________。
【答案】(1)第二周期第VA族;![]() ;
;
(2)![]() ;离子键,非极性键 ;2Na2O2+2H2O=4NaOH+ O2↑ ;
;离子键,非极性键 ;2Na2O2+2H2O=4NaOH+ O2↑ ;
(3)S2->Cl->Na+
(4)负;O+4e-+2H2O=4OH-。
【解析】
试题分析:A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,则A是H元素;B元素原子最外层电子数是次外层电子数的2倍,则B是C元素;D是地壳中含量最多的元素,D是O元素,所以C是N元素;E是短周期中金属性最强的元素,则E是Na元素;F与G位置相邻,G是同周期元素中原子半径最小的主族元素,则G是Cl元素,因此F是S元素。(1)C是N元素,在元素周期表中的位置为第二周期第VA族;G是Cl元素,G的原子结构示意图是![]() ;(2)D与E按原子个数比1:1形成化合物甲是Na2O2,其电子式为
;(2)D与E按原子个数比1:1形成化合物甲是Na2O2,其电子式为![]() ,所含化学键类型为离子键,非极性键,向甲中滴加足量水时发生反应的化学方程式是2Na2O2+2H2O=4NaOH+ O2↑。(3)E、F、G三种元素形成的简单离子分别是Na+、S2-、Cl-;对于电子层结构相同的离子来说,核电荷数越大,离子半径越小;对于电子层结构不同的离子来说,离子的电子数少的离子半径小。故三种离子半径由大到小的顺序是:S2->Cl->Na+;(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则通入燃料CH4的电极a极是该电池的负极,通入氧气的电极b电极是正极,正极的电极反应式为O+4e-+2H2O=4OH-。
,所含化学键类型为离子键,非极性键,向甲中滴加足量水时发生反应的化学方程式是2Na2O2+2H2O=4NaOH+ O2↑。(3)E、F、G三种元素形成的简单离子分别是Na+、S2-、Cl-;对于电子层结构相同的离子来说,核电荷数越大,离子半径越小;对于电子层结构不同的离子来说,离子的电子数少的离子半径小。故三种离子半径由大到小的顺序是:S2->Cl->Na+;(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则通入燃料CH4的电极a极是该电池的负极,通入氧气的电极b电极是正极,正极的电极反应式为O+4e-+2H2O=4OH-。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
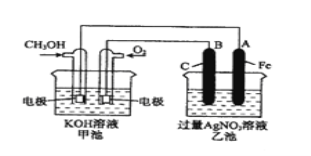
芒果教辅暑假天地重庆出版社系列答案【题目】实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
![]()
![]()
![]()
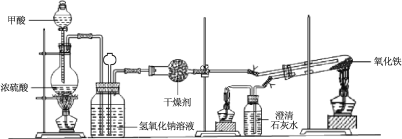
① 按上图连接好装置,检查装置气密性。
② 称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。
③ 在完成某项操作后,点燃另外两处酒精灯。
④ 30 min后熄灭酒精灯,关闭弹簧夹。
⑤ 待产物冷却至室温后,收集产物。
⑥ 采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物。
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为 ,该反应的化学方程式 。
(2)实验步骤③某项操作是指 。
(3)实验步骤④熄灭酒精灯的顺序为______________。(填I,II,III)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃。
II.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4。试分析酒精灯加热条件下生成Fe的原因是 。
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%。利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
加热方式 | 产物元素组成 | 各元素的质量分数%[§科§网] | |
Fe | O | ||
酒精灯 | Fe和O | 74.50 | 25.50 |
带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
酒精喷灯 | Fe | 100.00 | 0.00 |
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有_______种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为_____。(要求保留整数)