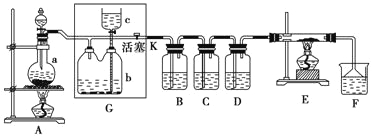
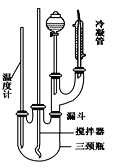
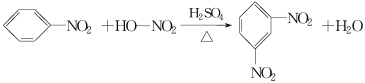题目内容
【题目】能源和环境保护是世界各国关注的热点话题。请回答下列问题:
Ⅰ.目前“低碳经济”正成为科学家研究的主要课题。甲烷自热重整是一种先进的制氢方法,其反应方程式为CH4(g) +H2O (g) =CO (g) +3H2(g) 。
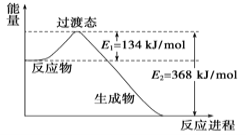
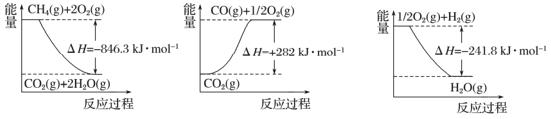
阅读下图,计算该反应的反应热△H=____________kJ·mol-1。
Ⅱ.收集和利用CO2是环境保护的热点课题。
500℃时,在容积为1L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:C02(g) +3H2 (g) =CH3OH (g) +H2O (g) △H<0,测得CO2和CH3OH的浓度与时间的关系如图所示。
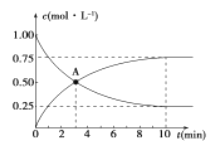
(1) 0~10 min内v(H2)=_____________, A点含义是_____________。该反应平衡常数表达式K=____________。
(2)反应在500℃达到平衡后,改变反应温度为T, CH3OH的浓度以每分钟0. 030 mol/L逐渐增大,经5 min又达到新平衡。T______(填“>”、“<”或“=”)500℃,判断理由是_____________。
(3)温度为T时,反应达到平衡后,将反应容器的容积增大一倍。平衡向____________(填“正”或“逆”)反应方向移动,判断理由是____________。
Ⅲ.电化学法处理SO2是目前研究的热点。
利用双氧水吸收SO2可消除SO2污染,设计装置如图所示。

(1)石墨1为___________(填“正极”或“负极”);正极的电极反应式为____________。
(2)若11.2 L(标准状况)SO2参与反应,则迁移H+的物质的量为____________。
【答案】Ⅰ. +161.1 KJ /molⅡ.
(1) 0.225 mol/(L·min) 该条件下反应3 min时,c(CO2)=c(CH3OH) K=。
(2)< , 改变温度,CH3OH的浓度增大,说明平衡向正反应方向移动,因该反应的正反应是放热反应,则T<500 ℃。
(3) 逆 该反应的逆反应是气体分子数增大的反应,增大容器的容积,相当于减小压强,平衡向气体分子数增大的方向移动。
Ⅲ.(1)负极 H2O2+2e-+2H+===2H2O。
(2) 1 mol
【解析】
试题分析:Ⅰ(1)由能量图,可得:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3kJmoL-1 ②CO2(g)═CO(g)+O2(g)△H=+282kJmoL-1 ③O2(g)+H2(g)═H2O(g)△H=-241.8kJmoL-1 根据盖斯定律,①-③×3+②可得:CH4(g)+H2O(g)=CO(g)+3H2(g),故△H=(-846.3+241.8×3+282)kJmoL-1=+161.1kJmoL-1;
Ⅱ.(1)由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=![]() =0.225mol/(Lmon);A点为两曲线交点,表示该条件下反应3 min时,c(CO2)=c(CH3OH);反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)的平衡常数K=;
=0.225mol/(Lmon);A点为两曲线交点,表示该条件下反应3 min时,c(CO2)=c(CH3OH);反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)的平衡常数K=;
(2)改变温度,CH3OH的浓度增大,说明平衡向正反应方向移动,因该反应的正反应是放热反应,则T<500 ℃;
(3)该反应的逆反应是气体分子数增大的反应,增大容器的容积,相当于减小压强,平衡向气体分子数增大的方向移动,故平衡向逆反应方向移动;
Ⅲ.(1)原电池工作时SO2被氧化,则石墨1为负极;正极的电极反应式为H2O2+2e-+2H+===2H2O;
(2)若11.2 L(标准状况)即0.5molSO2参与反应是转移电子数为0.5mol×2=1mol,则迁移H+的物质的量为1mol。

 阅读快车系列答案
阅读快车系列答案【题目】甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应 | 化学方程式 | 焓变△H | 正反应活化能Ea |
甲烷 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
蒸汽 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
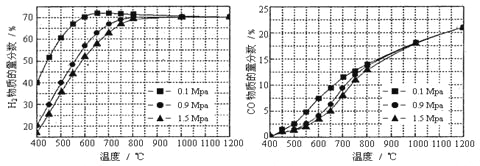
①若要达到H2物质的量分数>65%/span>、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9Mpa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1) A、B、D、E、F的原子半径由大到小排列的顺序为__________(用元素符号表示)
(2) 工业制备F单质的离子反应方程式为_________________。
(3) 由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 由D和E构成,且原子数之比为1:1 |
c | 化学组成EDF |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式 ;b的化学键类型 ;
c的一种作用 ;d的晶体类型 。
(4) 由A和B、D元素组成的两种二元化合物形成一类新能源物质。其中一种化合物分子通过 键构成具有空腔的固体;另一种化合物分子进入该空腔,形成可燃固体。