题目内容
【题目】实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
![]()
![]()
![]()
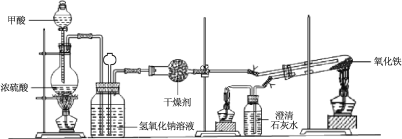
① 按上图连接好装置,检查装置气密性。
② 称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。
③ 在完成某项操作后,点燃另外两处酒精灯。
④ 30 min后熄灭酒精灯,关闭弹簧夹。
⑤ 待产物冷却至室温后,收集产物。
⑥ 采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物。
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为 ,该反应的化学方程式 。
(2)实验步骤③某项操作是指 。
(3)实验步骤④熄灭酒精灯的顺序为______________。(填I,II,III)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃。
II.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4。试分析酒精灯加热条件下生成Fe的原因是 。
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%。利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
加热方式 | 产物元素组成 | 各元素的质量分数%[§科§网] | |
Fe | O | ||
酒精灯 | Fe和O | 74.50 | 25.50 |
带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
酒精喷灯 | Fe | 100.00 | 0.00 |
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有_______种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为_____。(要求保留整数)
【答案】(1)分液漏斗(2分) HCOOH![]() CO↑ + H2O(2分) (2)检验CO纯度(2分)
CO↑ + H2O(2分) (2)检验CO纯度(2分)
(3)III,I,II (答III,II, I也给分)(2分)
(4)长时间集中加热使局部温度达到还原生成铁所需要的温度(2分)(其它正确答案参照给分)
(5)9种(2分) (6)12:1(2分)
【解析】
试题分析:(1)在浓硫酸加热条件下,HCOOH分解可得CO,根据质量守恒可知另一个产物为水,反应的化学方程式为:HCOOH![]() CO↑+H2O,盛放甲酸的仪器名称为分液漏斗。
CO↑+H2O,盛放甲酸的仪器名称为分液漏斗。
(2)CO是可燃性气体,因此应先检验CO纯度后点燃另外两处酒精灯,先检验CO纯度目的看试管内的空气是否排净,防止爆炸。
(3)实验结束后要等试管冷却后才停止通一氧化碳,故先熄灭Ⅲ处酒精灯,是为了防止生成热的铁被空气中的氧气氧化;应最后熄灭Ⅰ处酒精灯,目的是防止多余的一氧化碳进入空气中污染环境。所以实验步骤④熄灭酒精灯的顺序为 Ⅲ、Ⅱ、Ⅰ。
(4)加网罩酒精灯平均温度为700℃,当反应温度高于710℃,Fe能稳定存在,温度差比较小,长时间集中加热可使局部温度达到生成还原铁所需要的温度。
(5)由数据可知,Fe、FeO、Fe2O3、Fe3O4中Fe元素的百分含量分别为100﹪、77.8%、70%、72.4%,酒精灯加热所得产物中Fe元素的百分含量为74.50%,混合物中至少有一个Fe元素含量大于74.50%,至少有一个Fe元素含量小于74.50%,故混合物中一定有Fe和FeO中的至少一种,也一定有Fe2O3和Fe3O4中的一种,这样就会出现,两种混合的有4种:Fe、Fe2O3,Fe、Fe3O4,FeO、Fe2O3,FeO、Fe3O4,三种混合的有4种:Fe、Fe2O3和Fe3O4,FeO、Fe2O3和Fe3O4,Fe2O3、Fe和FeO,Fe3O4、Fe和FeO ,四种混合的有1种:Fe、FeO、Fe2O3和Fe3O4,共9种。
(6)根据酒精灯加热得到的产物为Fe3O4和Fe,且铁元素的百分含量为74.50%,设Fe3O4的质量为x,Fe的质量为y,则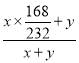 =74.50%,解得:
=74.50%,解得:![]() ≈12:1。
≈12:1。

 阅读快车系列答案
阅读快车系列答案