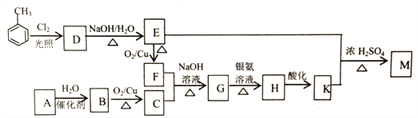
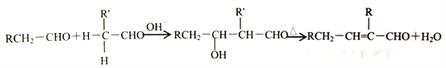
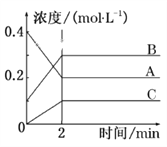
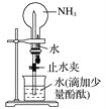
题目内容
【题目】1.92g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积可能是
A. 504mL B. 168mL C. 336mL D. 224mL
【答案】C
【解析】
根据电子守恒计算,已知Cu+HNO3![]() NO、NO2+O2
NO、NO2+O2![]() HNO3,则反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,以此进行计算。
HNO3,则反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,以此进行计算。
1.92g Cu的物质的量为n(Cu)= ![]() = 0.03 mol,反应时失去电子数目为2 × 0.03 mol = 0.06 mol,
= 0.03 mol,反应时失去电子数目为2 × 0.03 mol = 0.06 mol,
由反应整个过程为Cu+HNO3![]() NO、NO2+O2
NO、NO2+O2![]() HNO3可知,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,所以消耗氧气的物质的量为n(O2)=
HNO3可知,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,所以消耗氧气的物质的量为n(O2)=![]() = 0.015mol,V(O2)= 0.015 mol×22400 mL/mol = 336 mL,所以通入O2的体积为336mL,故C项正确;
= 0.015mol,V(O2)= 0.015 mol×22400 mL/mol = 336 mL,所以通入O2的体积为336mL,故C项正确;
答案选C。

练习册系列答案
相关题目