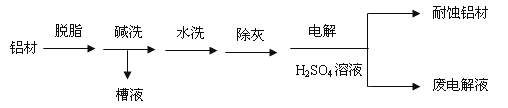
题目内容
【题目】下列电离方程式正确的是
A. H2SO3![]() 2H++SO32— B. NaHCO3
2H++SO32— B. NaHCO3![]() Na++HCO3— C. HF+H2O
Na++HCO3— C. HF+H2O![]() F-+H3O+ D. Ba(OH)2
F-+H3O+ D. Ba(OH)2![]() Ba2++2OH-
Ba2++2OH-
【答案】C
【解析】
物质在水溶液中的电离方程式书写原则是能溶于水的强电解质完全电离,用“=”,能溶于水的弱电解质存在电离平衡用“![]() ”,难溶的强电解质物质在水溶液中能溶解的全部电离。
”,难溶的强电解质物质在水溶液中能溶解的全部电离。
A、亚硫酸是中强酸,属于弱电解质,分步电离,H2SO3![]() H++HSO3-,故A错误;B、碳酸氢钠是强电解质,完全电离,正确的是:NaHCO3=Na++HCO3-,故B错误;C. 氢氟酸为弱酸,部分电离,HF+H2O
H++HSO3-,故A错误;B、碳酸氢钠是强电解质,完全电离,正确的是:NaHCO3=Na++HCO3-,故B错误;C. 氢氟酸为弱酸,部分电离,HF+H2O![]() F-+H3O+,故C正确;D.氢氧化钡为强电解质,完全电离,正确的电离方程式为:Ba(OH)2=Ba2++2OH-,故D错误;故选C。
F-+H3O+,故C正确;D.氢氧化钡为强电解质,完全电离,正确的电离方程式为:Ba(OH)2=Ba2++2OH-,故D错误;故选C。

练习册系列答案
相关题目