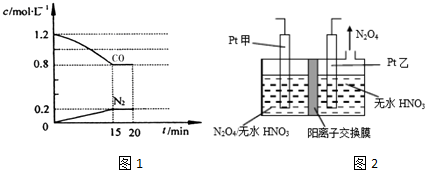
题目内容
6.下列说法正确的是( )| A. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度一定小于CD的溶解度 | |
| B. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| C. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,此反应能够进行是因为碳的还原性比硅强 | |
| D. | 弱酸也可以通过复分解反应制强酸,如:H2S+CuSO4=H2SO4+CuS↓ |
分析 A.由于AB2与CD分子组成形式不同,因此不能根据Ksp大小来比较溶解度的大小;
B.O、F无正价;
C.从元素周期率的角度分析,碳的还原性比硅弱;
D.CuS不溶于硫酸,符合复分解反应的原理.
解答 解:A.由于AB2与CD分子组成形式不同,因此不能根据KSP大小来比较溶解度的大小,故A错误;
B.O、F无正价,最高化合价为0,最高化合价在数值上不都等于该元素所属的族序数,故B错误;
C.气体CO分离出原体系,只能说明碳易与氧结合.高温下生成了气态的一氧化碳,一氧化碳是非常的稳定,又能脱离反应体系,才能使反应平衡右移,顺利进行.并非是能够简单的说明还原性问题,故C错误;
D.CuS不溶于硫酸,H2S酸性比硫酸弱,符合复分解反应的原理,故D正确.
故选D.
点评 本题考查较为综合,为高频考点,侧重于学生的分析能力的考查,注意溶度积、元素周期率等知识,难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
15.在密闭容器中进行X2(气)+2Y2(气)?Z(气)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
| A. | c(Z)=0.45mol/L | B. | c(X2)=0.3mol/L c(Z)=0.1 mol/L | ||
| C. | c(X2)=0.5mol/L | D. | c(Y2)=0.5mol/L |
14.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )


| A. | 外电路电子的移动方向:A→电源→B | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-═C6H12 |
1.将含有amol Na2CO3的纯碱溶液与含有b mol HCl的稀盐酸进行反应,若不考虑二氧化碳在水中的溶解,用NA表示阿伏加德罗常数的数值,则下列相关叙述中,正确的是( )
| A. | 此纯碱溶液中含有CO${\;}_{3}^{2-}$的数目为aNA | |
| B. | 若a<b<2a,生成标准状况下二氧化碳的体积可能是11.2b L或22.4(b-a)L | |
| C. | 若b≥2a,则两溶液相互滴加的顺序不同,反应生成的二氧化碳分子数目不同 | |
| D. | 若b≤a,则无论两溶液相互滴有加的顺序如何,反应过程中均有气泡产生 |
11.下列的反应的离子方程式书写正确的是( )
| A. | 向银氨溶液中加入盐酸:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O | |
| B. | 在少量Mg(OH)2悬浊液中加入氯化铵浓溶液:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| C. | 向硫酸铁溶液中加入硫化钠溶液:2Fe3++3S2-+6H2O=2Fe(OH)3↓+3H2S↑ | |
| D. | NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+=H2O+BaCO3↓ |
18.下列实验不合理的是( )
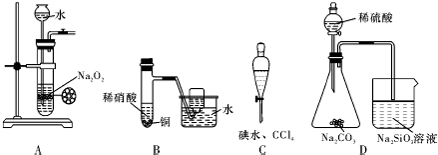

| A. | 制备少量氧气 | B. | 制备并收集少量NO气体 | ||
| C. | 四氯化碳萃取碘水中的碘 | D. | 证明非金属性强弱:S>C>Si |
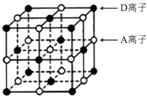 A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:
A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题: