题目内容
15. A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:
A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:(1)D基态原子的电子排布式为1s22s22p62s23p5.
(2)C单质在空气中燃烧产物的分子立体构型是V形.
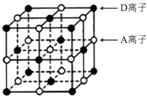
(3)E晶体的晶胞如右图所示,该晶胞中A离子的个数是4.
(4)B单质与A的最高价氧化物对应水化物的溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(5)D单质的水溶液中加入CaCO3固体,溶液中的含氧酸浓度增大,用平衡移动原理解释其原因氯水存在下列化学平衡Cl2+H2O?HCl+HClO;加入CaCO3固体,溶液中的强酸HCl和CaCO3反应,致上述化学平衡向正反应方向移动,HClO的浓度增加.
(6)将C的氢化物通入Fe2(SO4)3溶液中,有黄色沉淀生成.该反应的离子方程式是H2S+2Fe3+=S↓+2Fe2++2H+.
分析 A、B、C、D为短周期主族元素,原子序数依次增大.B是地壳中含量最高的金属元素,应为Al,C基态原子最外层原子轨道中有两个未成对电子且无空轨道,应为S元素,则D为Cl元素,A和D可形成化合物E,E的焰色反应呈黄色,说明含有Na元素,则A为Na,以此解答该题.
解答 解:A、B、C、D为短周期主族元素,原子序数依次增大.B是地壳中含量最高的金属元素,应为Al,C基态原子最外层原子轨道中有两个未成对电子且无空轨道,应为S元素,则D为Cl元素,A和D可形成化合物E,E的焰色反应呈黄色,说明含有Na元素,则A为Na,
(1)D为Cl元素,原子序数为17,基态原子的电子排布式为1s22s22p62s23p5,故答案为:1s22s22p62s23p5;
(2)C为S元素,在空气中燃烧产物为二氧化硫,中心原子形成2个σ键,孤电子对数为$\frac{6-2×2}{2}$=1,则为sp2杂化,分子立体构型是V形,故答案为:V形;
(3)由晶胞可知A位于棱和体心,则个数为12×$\frac{1}{4}$+1=4,故答案为:4;
(4)B为Al,单质与NaOH溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)氯气和水反应生成盐酸和次氯酸,次氯酸的酸性比碳酸弱,氯水存在下列化学平衡Cl2+H2O?HCl+HClO”溶液呈酸性,溶液中的强酸HCl和CaCO3反应,但次氯酸不反应,化学平衡向正反应方向移动,HClO的浓度增加,
故答案为:氯水存在下列化学平衡Cl2+H2O?HCl+HClO;加入CaCO3固体,溶液中的强酸HCl和CaCO3反应,致上述化学平衡向正反应方向移动,HClO的浓度增加;
(6)C为S,对应的氢化物具有还原性,可与Fe2(SO4)3溶液发生氧化还原反应生成S,反应的离子方程式为H2S+2Fe3+=S↓+2Fe2++2H+,
故答案为:H2S+2Fe3+=S↓+2Fe2++2H+.
点评 本题考查元素位置结构性质的综合应用,题目难度较大,注意正确推断元素的种类为解答该题的关键,本题中注意离子方程式的书写以及晶胞的计算.

 每课必练系列答案
每课必练系列答案 下列实验操作能达到实验目的是(必要时可加热)( )
下列实验操作能达到实验目的是(必要时可加热)( )| 甲 | 乙 | 丙 | 实验目的 | |
| A | 2mL10%的NaOH溶液 | 4-6滴2%的CuSO4溶液 | 0.5mL葡萄糖溶液 | 验证葡萄糖具有氧化性 |
| B | 2mL0.1mol/LAgNO3溶液 | 3滴0.1mol/LNaCl溶液 | 3滴0.1mol/LNaI溶液 | 验证AgCl可转化为溶解度更小的AgI |
| C | FeCl3溶液 | KSCN溶液 | 少量KCl固体 | 验证浓度对化学平衡的影响 |
| D | 3mL无水乙醇 | 2mL乙酸 | 2ml浓硫酸 | 配制反应液以制备乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度一定小于CD的溶解度 | |
| B. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| C. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,此反应能够进行是因为碳的还原性比硅强 | |
| D. | 弱酸也可以通过复分解反应制强酸,如:H2S+CuSO4=H2SO4+CuS↓ |
| A. | 硫酸铁可用作净水剂 | B. | 二氧化硅可用作计算机芯片 | ||
| C. | 铜制容器可用于盛装浓硝酸 | D. | 醋酸铅可用于分离提纯蛋白质 |
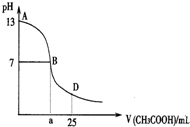 下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
| A. | c(OH-)一定大于c(CH3COO-) | B. | c(OH-)一定小于c(CH3COO-) | ||
| C. | c(OH-)一定等于c(CH3COO-) | D. | c(OH-)大于、小于或等于c(CH3COO-) |
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | 在Na2C2O4稀溶液中,c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| D. | 0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
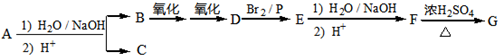

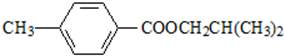 .
. ,该反应属于取代反应(或酯化反应)(填反应类型).
,该反应属于取代反应(或酯化反应)(填反应类型).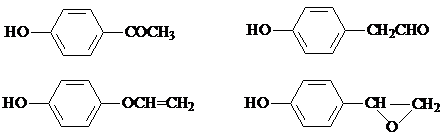 .
.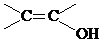 )结构.
)结构.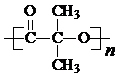 .
.