题目内容
11.下列的反应的离子方程式书写正确的是( )| A. | 向银氨溶液中加入盐酸:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O | |
| B. | 在少量Mg(OH)2悬浊液中加入氯化铵浓溶液:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| C. | 向硫酸铁溶液中加入硫化钠溶液:2Fe3++3S2-+6H2O=2Fe(OH)3↓+3H2S↑ | |
| D. | NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+=H2O+BaCO3↓ |
分析 A.向银氨溶液中加入盐酸,生成AgCl沉淀;
B.加入氯化铵浓溶液,促进氢氧化镁溶解;
C.发生氧化 还原反应生成FeS沉淀;
D.少量Ba(OH)2溶液完全反应,生成碳酸钡、碳酸钠和水.
解答 解:A.向银氨溶液中加入盐酸的离子反应为[Ag(NH3)2]++OH-+Cl-+3H+=AgCl↓+2NH4++H2O,故A错误;
B.在少量Mg(OH)2悬浊液中加入氯化铵浓溶液的离子反应为Mg(OH)2+2NH4+=2NH3•H2O+Mg2+,故B正确;
C.向硫酸铁溶液中加入硫化钠溶液的离子反应为2Fe3++3S2-=2FeS↓+S↓,故C错误;
D.NaHCO3溶液和少量Ba(OH)2溶液混合的离子反应为2HCO3-+2OH-+Ba2+=H2O+BaCO3↓+CO32-,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应及与量有关的离子反应考查,题目难度不大.

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
2.某同学在常温下设计以下实验流程探究Na2S2O3的化学性质:pH=8$\underset{\stackrel{①}{←}}{pH试纸}$Na2S2O3溶液$→_{同时加入氯化钡溶液}^{②加入足量氨水}$白色沉淀B
下列说法正确的是( )
下列说法正确的是( )
| A. | 实验①说明Na2S2O3溶液中水电离的c(OH-)=l0-8 mol.L-l | |
| B. | Na2S2O3溶液pH=8的原因用离子方程式表示为S2O32-+2H2O?Na2S2O3+2OH- | |
| C. | 生成的沉淀B可能是BaSO3或BaSO4,要进一步确认还需再加入稀硝酸验证 | |
| D. | 实验②说明Na2S2O3具有还原性 |
6.下列说法正确的是( )
| A. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度一定小于CD的溶解度 | |
| B. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| C. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,此反应能够进行是因为碳的还原性比硅强 | |
| D. | 弱酸也可以通过复分解反应制强酸,如:H2S+CuSO4=H2SO4+CuS↓ |
16.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 71gNa2SO4固体中含钠离子数目为NA | |
| B. | 28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA | |
| C. | 标准状况下,22.4LHF中含HF分子数目为NA | |
| D. | 25g质量分数为68%的H2O2水溶液中含氧原子数目为NA |
20.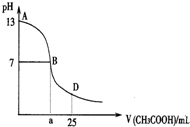 下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
c(CH3COO-)大小关系是( )
 下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与
下图为向25mL 0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
| A. | c(OH-)一定大于c(CH3COO-) | B. | c(OH-)一定小于c(CH3COO-) | ||
| C. | c(OH-)一定等于c(CH3COO-) | D. | c(OH-)大于、小于或等于c(CH3COO-) |
1.下列说法中正确的是( )
| A. | 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 | |
| B. | AgCl悬浊液中存在平衡:AgCl(s)═Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 | |
| C. | AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI) | |
| D. | 硬水中含有较多的Ca2+?Mg2+?HCO3-、SO42-,加热煮沸可以完全除去其中的Ca2+?Mg2+ |
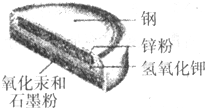 某种钮扣电池的剖面结构如图所示.请回答下列问题:
某种钮扣电池的剖面结构如图所示.请回答下列问题:

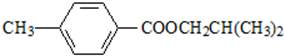 .
. ,该反应属于取代反应(或酯化反应)(填反应类型).
,该反应属于取代反应(或酯化反应)(填反应类型).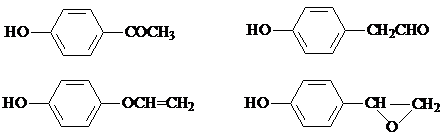 .
.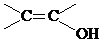 )结构.
)结构.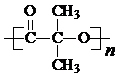 .
.