题目内容
14.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
| A. | 外电路电子的移动方向:A→电源→B | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-═C6H12 |
分析 根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极,据此分析.
解答 解:A、A是负极、B是正极,外电路中电子从B→电极→A,故A错误;
B、E作阳极,在阳极上生成气体X应该具有氧化性,故B错误;
C、电极D、E都必须是惰性电极,故C错误;
D、该装置的目的是储氢,所以阴极上发生的反应为生产目标产物,在D电极上苯中的碳得电子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故D正确;
故选D.
点评 本题考查了电解池的反应原理,明确D作阴极,E作阳极是解答的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.元素性质呈现周期性变化的根本原因是( )
| A. | 元素的原子量逐渐增大 | B. | 核外电子排布呈周期性变化 | ||
| C. | 核电荷数逐渐增大 | D. | 元素化合价呈周期性变化 |
5. 下列实验操作能达到实验目的是(必要时可加热)( )
下列实验操作能达到实验目的是(必要时可加热)( )
 下列实验操作能达到实验目的是(必要时可加热)( )
下列实验操作能达到实验目的是(必要时可加热)( )| 甲 | 乙 | 丙 | 实验目的 | |
| A | 2mL10%的NaOH溶液 | 4-6滴2%的CuSO4溶液 | 0.5mL葡萄糖溶液 | 验证葡萄糖具有氧化性 |
| B | 2mL0.1mol/LAgNO3溶液 | 3滴0.1mol/LNaCl溶液 | 3滴0.1mol/LNaI溶液 | 验证AgCl可转化为溶解度更小的AgI |
| C | FeCl3溶液 | KSCN溶液 | 少量KCl固体 | 验证浓度对化学平衡的影响 |
| D | 3mL无水乙醇 | 2mL乙酸 | 2ml浓硫酸 | 配制反应液以制备乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
2.某同学在常温下设计以下实验流程探究Na2S2O3的化学性质:pH=8$\underset{\stackrel{①}{←}}{pH试纸}$Na2S2O3溶液$→_{同时加入氯化钡溶液}^{②加入足量氨水}$白色沉淀B
下列说法正确的是( )
下列说法正确的是( )
| A. | 实验①说明Na2S2O3溶液中水电离的c(OH-)=l0-8 mol.L-l | |
| B. | Na2S2O3溶液pH=8的原因用离子方程式表示为S2O32-+2H2O?Na2S2O3+2OH- | |
| C. | 生成的沉淀B可能是BaSO3或BaSO4,要进一步确认还需再加入稀硝酸验证 | |
| D. | 实验②说明Na2S2O3具有还原性 |
9.利尿酸的结构简式如下图.下列有关利尿酸的说法不正确的是( )
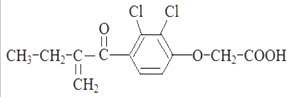

| A. | 分子式是C13H14O4Cl2 | |
| B. | 一定条件下能发生消去反应 | |
| C. | -定条件下能发生加聚反应 | |
| D. | 1mol利尿酸最多能与5molH2发生加成反应 |
6.下列说法正确的是( )
| A. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度一定小于CD的溶解度 | |
| B. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| C. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,此反应能够进行是因为碳的还原性比硅强 | |
| D. | 弱酸也可以通过复分解反应制强酸,如:H2S+CuSO4=H2SO4+CuS↓ |
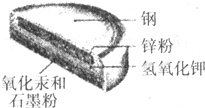 某种钮扣电池的剖面结构如图所示.请回答下列问题:
某种钮扣电池的剖面结构如图所示.请回答下列问题: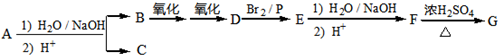
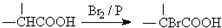
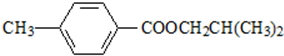 .
.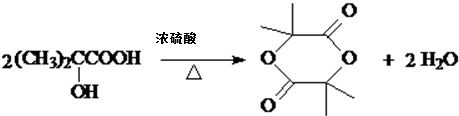 ,该反应属于取代反应(或酯化反应)(填反应类型).
,该反应属于取代反应(或酯化反应)(填反应类型).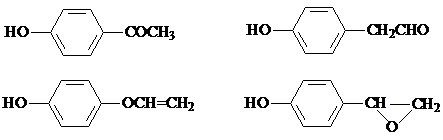 .
.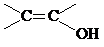 )结构.
)结构.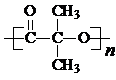 .
.