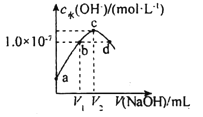
题目内容
【题目】铬、硼的合金及其化合物用途非常广泛。回答下列问题:
(1)基态Cr原子核外电子的排布式是[Ar] ___;基态硼原子中占据最高能级的电子云轮廓图为____形。
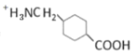
(2)铬的配合物有氯化三乙二胺合铬![]() 和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
①配体en表示NH2CH2CH2NH2,其中碳原子的杂化方式是____。
②NH4+空间构型为____,与其键合方式相同且空间构型也相同的含硼阴离子是_____ 。
③C、N、O三种元素第一电离能由小到大的顺序为 ___;![]() 含有三个五元环,画出其结构:_______________。
含有三个五元环,画出其结构:_______________。
(3)硼酸[H3BO3或B(OH)3]为白色片状晶体,熔点为171℃。下列说法正确的是___填字母)。
A.硼酸分子中,∠OBO的键角为120° B.硼酸分子中存在σ键和π键
C.硼酸晶体中,片层内存在氢键 D.硼酸晶体中,片层间存在共价键
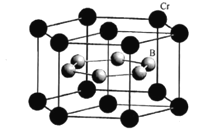
(4)2019年11月《EurekAlert》报道了铬基氮化物超导体,其晶胞结构如图所示:

由三种元素Pr(镨)、Cr、N构成的该化合物的化学式为 ___。
(5)CrB2的晶胞结构如图所示,六棱柱底边边长为acm,高为c cm,阿伏加德罗常数的值为NA,CrB2的密度为 ___gcm-3(列出计算式)。
【答案】3d54s1 哑铃(纺锤) sp3 正四面体 BH4- C<O<N 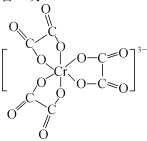 ABC Pr3Cr10N11
ABC Pr3Cr10N11 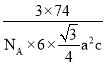 (或
(或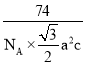 )
)
【解析】
(1)Cr为24号元素,基态Cr原子核外电子的排布式1s22s22p63s23p63d54s1,可表示为[Ar] 3d54s1;基态硼原子核外电子的排布式1s22s22p1,占据最高能级为2p,电子云轮廓图为哑铃(纺锤)型;
(2)①配体en表示NH2CH2CH2NH2,其中碳原子都是以单键连接,类似于甲烷中的碳原子键连方式,为sp3杂化;
②NH4+的中心原子为N,价层电子对数=4+![]() ×(5-1-1×4)=4,为sp3杂化,空间构型为正四面体型;互为等电子体的微粒,键合方式和空间构型相同,与NH4+互为等电子体的含硼阴离子为BH4-;
×(5-1-1×4)=4,为sp3杂化,空间构型为正四面体型;互为等电子体的微粒,键合方式和空间构型相同,与NH4+互为等电子体的含硼阴离子为BH4-;
③同周期元素从左到右电离能逐渐增大,处于全满、半满、全空状态处于稳定状态,比相邻元素电离能大;N原子最外层电子为半充满稳定状态,C、N、O三种元素第一电离能由小到大的顺序为C<O<N;![]() 含有三个五元环,Cr3+为配体,与C2O42-形成六个键,其结构为:
含有三个五元环,Cr3+为配体,与C2O42-形成六个键,其结构为: ;
;
(3)A.硼酸分子中心原子为B,B是sp2杂化,B和3个O共面形成平面三角形,则∠OBO的键角为120°,故A正确;
B.硼酸分子中每个硼原子最外层连有三个共价键,硼原子本身含有电子,故分子中硼原子最外层为6电子结构,形成离域π键,O原子与H原子以共价单键相连即含有σ键,故B正确;
C.硼酸是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连,故C正确;
D.硼酸晶体熔沸点较低,属于分子晶体,片层间是分子间作用力,故D错误;
答案选ABC;
(4)Pr6N9位于晶胞的棱上和体心,个数为12×![]() +1=4个,Cr8N13位于晶胞的顶点和面心,个数为8×
+1=4个,Cr8N13位于晶胞的顶点和面心,个数为8×![]() +6×
+6×![]() =4个,Cr6位于晶胞的体心,个数为8个,则一个晶胞中含有24个Pr、88个N和80个Cr,则分子式为Pr3Cr10N11;
=4个,Cr6位于晶胞的体心,个数为8个,则一个晶胞中含有24个Pr、88个N和80个Cr,则分子式为Pr3Cr10N11;
(5)Cr位于晶胞的顶点和上下面的面心,个数为12×![]() +2×
+2×![]() =3,B原子位于晶胞的体心,个数为6个,即一个晶胞中含有3个CrB2,底面积是6×
=3,B原子位于晶胞的体心,个数为6个,即一个晶胞中含有3个CrB2,底面积是6×![]() a2,高为c,则六棱柱的体积V=6×
a2,高为c,则六棱柱的体积V=6×![]() a2c,根据ρ=
a2c,根据ρ=![]() =
=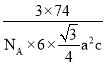 。
。

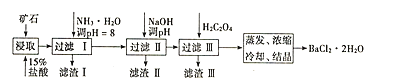
【题目】某矿石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用该矿石制备BaCl22H2O的流程如图,且三次滤渣的主要成分各不相同:
如表为常温时各离子转化为氢氧化物沉淀时的pH:
Fe3+ | Mg2+ | Ca2+ | |
开始沉淀时的pH | 1.9 | 9.1 | 11.9 |
完全沉淀时的pH | 3.2 | 11.1 | 13.9 |
(1)用15%盐酸浸取前需充分研磨,目的是______。
(2)滤渣Ⅰ的主要成分为______;加入NaOH调pH的范围为______;加入H2C2O4时应避免过量的原因是______。[已知难溶物质:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)已知:25℃时,Ksp(BaCO3)=5.4×10-9,Ksp(CaCO3)=2.7×10-9。向CaCO3固体的溶液中加入高浓度的BaCl2溶液,有BaCO3沉淀生成,请写出该反应的离子方程式______,该反应的平衡常数K=______。
(4)取制得的BaCl22H2O(含少量杂质)2.5g配成100mL溶液,取10.00mL该溶液于烧杯中,加入足量(NH4)2C2O4溶液,过滤,洗涤,将得到的BaC2O4沉淀用过量稀硫酸溶液溶解,过滤除去BaSO4沉淀,将所得的H2C2O4溶液移入锥形瓶,用0.05mol/L高锰酸钾标准液滴定至终点。
已知:Ba2++C2O42-═BaC2O4↓
BaC2O4+2H++SO42-═BaSO4↓+H2C2O4
5H2C2O4+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
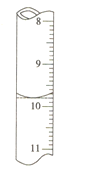
①滴定中盛放高锰酸钾标准液的仪器为______,滴入最后一滴高锰酸钾溶液,锥形瓶中溶液颜色______,即说明达到滴定终点。
②若滴定前滴定管的读数为1.80mL,滴定终点时滴定管中液面如图,请计算BaCl22H2O的纯度为______(保留3位有效数字)。