题目内容
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为______。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,E(H﹣Cl)=432kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣H)=_____。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
(4)如图是N2(g)和H2(g)反应生成2molNH3(g)过程中能量变化示意图:
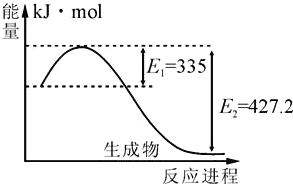
①请计算每生成1molNH3放出热量为:______。
②若起始时向容器内充入1molN2和3molH2达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________。
【答案】CH3OH(l)+![]() O2(g) =CO2(g)+H2O(l) △H=﹣704kJ/mol 436 kJ/mol C(s) +2 CuO (s) == Cu2O(s) +CO(g) △H=+34.5kJ/mol 41.6 kJ 18.44
O2(g) =CO2(g)+H2O(l) △H=﹣704kJ/mol 436 kJ/mol C(s) +2 CuO (s) == Cu2O(s) +CO(g) △H=+34.5kJ/mol 41.6 kJ 18.44
【解析】
(1)依据燃烧热的概念,是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据题干所给量计算1mol甲醇燃烧生成二氧化碳和液态水放出的热量,再书写反应的热化学方程式;
(2)根据反应热=反应物总键能-生成物总键能计算;
(3)根据盖斯定律分析解答;
(4)①△H=反应物的活化能-生成物的活化能计算生成2mol氨气放出的能量,再计算得到1mol氨气放出的热量;②依据氮气的转化率计算生成氨气的物质的量,结合热化学方程式计算Q1。
(1)在25℃、101kPa下,16g甲醇(CH3OH)燃烧生成CO2和液态水时放热352kJ,32g甲醇燃烧生成二氧化碳和液态水放出热量为704kJ,则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-704kJmol-1,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=-704kJmol-1,故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-704kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-704kJmol-1;
(2) △H=反应物总键能-生成物总键能=E(H﹣H)+243kJ/mol-2×432kJ/mol =-185kJ/mol,解得E(H-H)=436kJ/mol,故答案为:436 kJ/mol;
(3)①2Cu(s)+![]() O2(g)═Cu2O(s) △H=-169kJmol-1,②C(s)+
O2(g)═Cu2O(s) △H=-169kJmol-1,②C(s)+![]() O2(g)═CO(g) △H=-110.5kJmol-1,③2Cu(s)+O2(g)═CuO(s) △H=-314kJmol-1,用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO(s)=Cu(s)+CO(g),根据盖斯定律,将②-③-
O2(g)═CO(g) △H=-110.5kJmol-1,③2Cu(s)+O2(g)═CuO(s) △H=-314kJmol-1,用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO(s)=Cu(s)+CO(g),根据盖斯定律,将②-③-![]() ×①,反应的焓变为-110.5kJmol-1-(-314kJmol-1)-
×①,反应的焓变为-110.5kJmol-1-(-314kJmol-1)- ![]() ×(-169kJmol-1)=34.5kJmol-1,故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g) △H=+34.5kJmol-1;
×(-169kJmol-1)=34.5kJmol-1,故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g) △H=+34.5kJmol-1;
(4)①如图是N2和H2反应生成2molNH3过程中能量变化示意图,反应焓变△H=反应物的活化能-生成物的活化能=335kJ/mol-427.2kJ/mol=-92.2kJ/mol,所以生成1mol氨气放热46.1kJ,故答案为:46.1kJ;
②如图是N2和H2反应生成2molNH3过程中能量变化示意图,反应焓变△H=335kJ/mol-427.2kJ/mol=-92.2kJ/mol,起始时向容器内充入1molN2和3molH2达平衡后N2的转化率为20%,生成氨气的物质的量为1mol ×20%×2=0.4mol,生成0.4mol氨气放出的热量=![]() ×92.2kJ=18.44kJ,故答案为:18.44。
×92.2kJ=18.44kJ,故答案为:18.44。