题目内容
12.相同条件下pH=3的盐酸和pH=3的醋酸:(1)取等体积两溶液,分别稀释至pH=4时,两者加水量的关系是:前者<后者;(填“>”、“<”或“=”,下同)
(2)取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者<后者.
分析 (1)醋酸为弱酸,相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,水中存在电离平衡:CH3COOH?CH3COO-+H+,加水稀释促进电离;
(2)从弱电解质的电离平衡移动的角度分析.
解答 解:(1)因为醋酸为弱酸,相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,水中存在:CH3COOH?CH3COO-+H+,加入水使c(H+)浓度减小,平衡右移,又有部分H+被电离出来,当稀释至c(H+)相同时,需要比强酸盐酸更多的水来稀释,故答案为:<;
(2)盐酸是强酸,相应的钠盐的水溶液呈中性,即PH=7,醋酸溶液中存在CH3COOH?CH3COO-+H+,加入CH3COONa,溶液CH3COO-浓度增大,抑制醋酸电离,溶液c(H+)减小,所以前者的PH小于后者,故答案为:<.
点评 本题考查强弱电解质的比较以及盐类水解的影响因素,注意把握弱电解质的电离特点以及电离平衡移动的影响因素,题目难度不大.

练习册系列答案
相关题目
15.氰酸铵(NH4CNO)与尿素[CO(NH2)2]( )
| A. | 互为同系物 | B. | 互为同分异构体 | C. | 都是共价化合物 | D. | 都是有机化合物 |
20.下列物质的沸点逐渐升高的是( )
| A. | NH3 PH3 AsH3 SbH3 | B. | Si SiC H2O CO2 | ||
| C. | NaI NaBr NaCl NaF | D. | Li Na K Rb |
7.某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据表中的实验现象回答下列问题:
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:2Al-6e-═2Al3+;
总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:2Al-6e-═2Al3+;
总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
17.下表实验中“操作及现象”与“给定溶液”的性质不对应的是( )
| 选项 | 溶液 | 操作及现象 |
| A | Ca(OH)2溶液 | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊. |
| B | 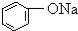 溶液 溶液 | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失. |
| C | Ca(ClO)2溶液 | 通入CO2,溶液没有明显变化.再滴入品红溶液,红色褪去. |
| D | CaCl2溶液 | 通入CO2,溶液没有明显变化.若同时通入CO2和NH3,则溶液变浑浊. |
| A. | A | B. | B | C. | C | D. | D |
4.下列有关说法不正确的是( )
| A. | 要清洗附着在试管壁上的硫,可用的试剂是CS2 | |
| B. | 硫化亚铁溶于稀硝酸中反应的化学方程式为:FeS+2HNO3→Fe(NO3)2+H2S↑ | |
| C. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| D. | 在Na2SO3和BaCO3混合物中加入过量的稀硫酸,能产生气泡并有沉淀生成 |
1.下列关于甲烷的说法不正确的是( )
| A. | 甲烷的分子式是CH4,是H元素质量分数含量最高的烃 | |
| B. | 甲烷中最多三个原子共面 | |
| C. | CCl4可由CH4制得,CCl4可萃取碘水中的碘 | |
| D. | 1 mol甲烷和氯气光照充分反应,最多消耗2mol氯气 |
2.关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是( )
| A. | N5+共有34个核外电子 | B. | N5+中氮原子间以共价键结合 | ||
| C. | 化合物N5ASF6中AS的化合价为+1价 | D. | 化合物N5ASF6中F的化合价为-1价 |
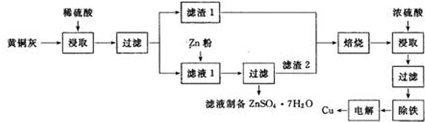 铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.
铜是一种重要的有色金属,近些年来铜的用途越来越广泛.铜矿有辉铜矿(主要成分为Cu2S)、斑铜矿(主要成分为Cu5FeS4)、蓝铜矿[主要成分为Cu2(OH)2CO3]及黄铜矿(主要成分为CuFeS2)等.