题目内容
4.下列有关说法不正确的是( )| A. | 要清洗附着在试管壁上的硫,可用的试剂是CS2 | |
| B. | 硫化亚铁溶于稀硝酸中反应的化学方程式为:FeS+2HNO3→Fe(NO3)2+H2S↑ | |
| C. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| D. | 在Na2SO3和BaCO3混合物中加入过量的稀硫酸,能产生气泡并有沉淀生成 |
分析 A.依据硫易溶于二硫化碳的性质解答;
B.硝酸具有强的氧化性,能够氧化二价铁离子和硫离子;
C.浓硫酸具有强的氧化性,能够使铁铝钝化,形成氧化膜,阻止反应进行;
D.硫酸的酸性强于亚硫酸和碳酸.
解答 解:A.硫易溶于二硫化碳,要清洗附着在试管壁上的硫,可用的试剂是CS2,故A正确;
B.硫化亚铁溶于稀硝酸中的化学方程式为:FeS+4HNO3=Fe(NO3)3+NO↑+S↓+2H2O,故B错误;
C.浓硫酸具有强的氧化性,能够使铁铝钝化,形成氧化膜,阻止反应进行,故C正确;
D.硫酸的酸性强于亚硫酸和碳酸,硫酸雨亚硫酸钠反应生成二氧化硫,与碳酸钡反应生成硫酸钡沉淀,故D正确;
故选:B.
点评 本题考查了元素化合物知识,熟悉浓硫酸、浓硝酸的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
7.下列说法中正确的是( )
| A. | 在一定体积和浓度的醋酸和氢氧化钠的混合液中一定存在:c(OH-)+c(CH3COO-)=c(H+)+c(Na+) | |
| B. | 常温下pH=10的NaOH和NH3•H2O,加水稀释至pH=9,NaOH加水多 | |
| C. | 难溶电解质CaF2饱和溶液中,c(Ca2+)=amol/L,c(F-)=bmol/L,则Ksp=4ab | |
| D. | 0.1mol/L的碳酸钠溶液中,阴离子浓度大小顺序为:c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) |
15.下列关于${\;}_{2}^{3}He$的说法中正确的是( )
| A. | ${\;}_{2}^{3}He$原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}He$原子核外有3个电子 | |
| C. | ${\;}_{3}^{4}He$原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}He$和${\;}_{2}^{4}He$是两种不同的核素 |
19.已两种气态烃以任意比例混合,在105℃时,1L该混合烃与9L氧气混合,充分燃烧,恢复到原状态,所得气体仍为10L,则这两种烃不可能是( )
| A. | CH4和C2H4 | B. | CH4和C3H6 | C. | C2H4和C3H4 | D. | C2H2和C3H6 |
9.Na2S2O3•5H2O(俗称海波)是照相业常用的一种定影剂.工业上制得的Na2S2O3•5H2O晶体中可能含有少量的Na2SO3和Na2SO4杂质.为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出.(Na2S2O3+H2SO4γNa2SO4+SO2↑+S↓+H2O)
测得有关实验数据如下(标准状况):
(摩尔质量:Na2S2O3•5H2O 248g/mol; Na2SO3126g/mol;Na2SO4 142g/mol)
(1)计算所用硫酸溶液的物质的量浓度.
(2)分析以上实验数据,该样品中d(填写选项字母).
A.仅含有Na2S2O3•5H2O
B.含有和Na2S2O3•5H2O和Na2SO3,无Na2SO4
C.含有Na2S2O3•5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热.试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的S02体积(b L)的值(可用含a的关系式表示).
测得有关实验数据如下(标准状况):
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.8 | 1.6 | 3.2 |
(1)计算所用硫酸溶液的物质的量浓度.
(2)分析以上实验数据,该样品中d(填写选项字母).
A.仅含有Na2S2O3•5H2O
B.含有和Na2S2O3•5H2O和Na2SO3,无Na2SO4
C.含有Na2S2O3•5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热.试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的S02体积(b L)的值(可用含a的关系式表示).
16.常见的离子晶体类型有五种,右图是其中的一种空间构型.则该晶体的化学式可能为( )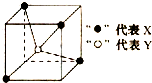

| A. | YX4 | B. | XY2 | C. | YX | D. | YX2 |
13.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA | |
| B. | 1mol/LFeCl3 溶液中所含Fe3+的数目小于NA | |
| C. | 常温下,1L pH=12的Ba(OH)2 溶液中含OH-的数目为2NA | |
| D. | 23g NO2和N2O4的混合气体中含有氮原子数为0.5NA |