题目内容
【题目】Ⅰ.某温度时,在一个10L的恒容容器中X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
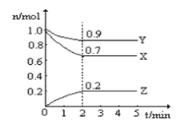
⑴该反应的化学方程式为___________;
⑵反应开始至2min,以气体Z表示的平均反应速率为___________;
⑶平衡时容器内混合气体密度比起始时_________(填“变大”,“变小”或“不变”下同),混合气体的平均相对分子质量比起始时___________;
⑷将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=__________。
Ⅱ.已知硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4= Na2SO4+ SO2↑+S↓+H2O,某学习小组探究一定条件下影响化学反应速率的因素,如下表所示:
⑸对比实验I、III可以得出的结论是______________,实验I、II探究的是___________的浓度越大,该反应速率越快,若实验III、IV也想得出同样结论,X=___________,Y= _________。
实验序号 | 温度 | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL-1) | V/mL | c/(molL-1) | V/mL | ||
I | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
II | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
III | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
IV | 35 | 5 | 0.2 | X | 0.2 | Y |
【答案】3X+Y2Z 0.01mol/(Lmin) 不变 变大 7:5 当其他条件不变时,温度越高,化学反应速率越快 Na2S2O3溶液 5 10
【解析】
Ⅰ.(1)化学方程式中,反应的物质系数之比等于各个物质的量的变化量之比;
(2)根据化反应速率v=![]() 来计算化学反应速率;
来计算化学反应速率;
(3)混合气体的平均相对分子质量M=![]() ,混合气体密度ρ=
,混合气体密度ρ=![]() 来判断;
来判断;
(4)根据化学反应中的三段式进行计算;
Ⅱ.表中给出的数据为浓度和温度的影响,一般来说,浓度越大,温度越高,反应速率越大,以此解答该题。
Ⅰ.(1)根据图示的内容知道,X和Y是反应物,X、Y、Z的变化量之比是0.3:0.1:0.2=3:1:2,反应的化学方程式为:3X+Y![]() 2Z;
2Z;
(2)反应开始至2min,以气体Z表示的平均反应速率v= =0.01 mol/(L·min);
=0.01 mol/(L·min);
(3)混合气体密度ρ=![]() ,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,混合气体的平均相对分子质量M=
,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,混合气体的平均相对分子质量M=![]() ,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,故答案为:相等;大;
,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,故答案为:相等;大;
(4) 3X+Y![]() 2Z(设Y的变化量是x)
2Z(设Y的变化量是x)
初始量:a b 0
变化量:3x x 2x
平衡量:a-3x b-x 2x
当n (X)=n (Y)=2n (Z)时,a-3x=b-x=4x,则a=7x,b=5x,所以原混合气体中a:b=7:5;
Ⅱ.⑸对比实验I、III只有温度不同,可以得出的结论是当其他条件不变时,温度越高,化学反应速率越快,实验I、II只有Na2S2O3溶液的浓度不同,其他条件相同,故探究的是Na2S2O3溶液的浓度越大,该反应速率越快,若实验III、IV也想得出同样结论,则应除温度外保持与II的数据相同,则X=5,Y=10。