题目内容
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:
A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A._____,B._____。(填“能”或“不能”)
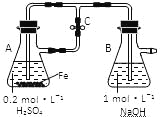
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲________乙(填“>”、“<“或“=”)。
③请写出图中构成原电池的负极电极反应式_________________________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入__极(填a或b),电子从____(填a或b)极流出。
【答案】不能 能 BD > Zn-2e-=Zn2+ b b
【解析】
(1)A.NaOH+HCl=NaCl+H2O不是氧化还原反应,不能设计成原电池;B.Zn+H2SO4=ZnSO4+H2↑是自发进行的氧化还原反应,能设计成原电池;
(2)甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
①A.甲是化学能转变为电能的装置,乙不是,故A错误;
B.乙装置中铜片不反应,也没构成原电池的正极,所以铜片上没有明显变化,故B正确;
C.甲、乙中锌片质量都减少,故C错误;
D.两个烧杯中都产生氢气,氢离子浓度都降低,所以溶液的pH均增大,故D正确;
故答案为BD;
②原电池原理引起的反应速度大于化学反应的速度,因此在相同时间内,两烧杯中产生气泡的速度:甲>乙;
③构成原电池的负极是锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+;
(3)氢氧燃料电池中,燃料氢气需通在负极,即b极,正极是氧气得电子,电子从负极b流向正极a。

【题目】Ⅰ.某温度时,在一个10L的恒容容器中X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

⑴该反应的化学方程式为___________;
⑵反应开始至2min,以气体Z表示的平均反应速率为___________;
⑶平衡时容器内混合气体密度比起始时_________(填“变大”,“变小”或“不变”下同),混合气体的平均相对分子质量比起始时___________;
⑷将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=__________。
Ⅱ.已知硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4= Na2SO4+ SO2↑+S↓+H2O,某学习小组探究一定条件下影响化学反应速率的因素,如下表所示:
⑸对比实验I、III可以得出的结论是______________,实验I、II探究的是___________的浓度越大,该反应速率越快,若实验III、IV也想得出同样结论,X=___________,Y= _________。
实验序号 | 温度 | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL-1) | V/mL | c/(molL-1) | V/mL | ||
I | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
II | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
III | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
IV | 35 | 5 | 0.2 | X | 0.2 | Y |
【题目】下表是元素周期表的一部分,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
⑴在这些元素中,最活泼的非金属元素是___________,化学性质最不活泼的元素是______________。
⑵表中金属性最强的元素是_______________,其原子结构示意图为 _______________________ 。
⑶表中元素的最高价氧化物对应的水化物中酸性最强的是__________,呈两性的氢氧化物是______。
⑷元素⑩的元素符号为 ____________ ,元素⑦的原序数为_________。
⑸在①~③元素中,原子半径最大的是_____________,原子半径最小的是_____________。
⑹十种元素中有一种元素的氢化物水溶液呈碱性,该氢化物的电子式为________。