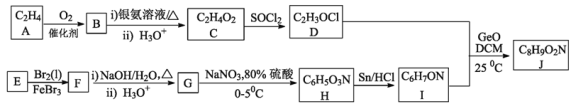
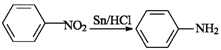
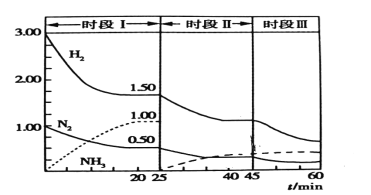
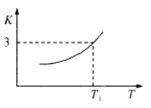
题目内容
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图:
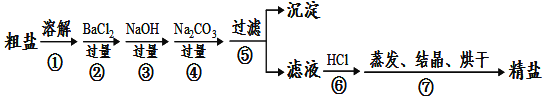
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是______。
(2)第②步操作的目的是除去粗盐中的______(填化学式,下同),第⑥步操作的目的是除去滤液中______。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、______(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是______。
(5)实验所得精盐的质量大于粗盐中NaCl的质量,原因是______。
【答案】加快粗盐溶解 Na2SO4 NaOH、Na2CO3 CaCO3、BaCO3 会引入K+ 在提纯过程中生成了氯化钠
【解析】
由题给流程图可知,第①步为粗盐溶解操作;第②步操作加入过量BaCl2溶液的目的是除去粗盐中的Na2SO4,但同时引入了BaCl2杂质;第③步操作加入过量NaOH溶液的目的是除去粗盐中MgCl2,但同时引入了NaOH杂质;第④步操作加入过量的Na2CO3溶液的目的是除去粗盐中的氯化钙和过量的氯化钡,但同时引入了Na2CO3杂质;第⑤步过滤操作,得到含有氢氧化钠和碳酸钠杂质的氯化钠溶液;第⑥步操作加入适量盐酸的目的是除去滤液中过量的氢氧化钠和碳酸钠杂质;第⑦步操作为蒸发、结晶、烘干得到精盐。
(1)在第①步粗盐溶解操作中用玻璃棒搅拌,加速了液体的流动,使固体很快溶解,故答案为:加快粗盐溶解;
(2)第②步操作加入过量BaCl2溶液的目的是除去粗盐中的Na2SO4;第⑥步操作的目的是除去滤液中过量的氢氧化钠和碳酸钠杂质,故答案为:Na2SO4;NaOH、Na2CO3;
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、第②步操作生成的BaSO4、第③步操作生成的Mg(OH)2、第④步操作生成的CaCO3和BaCO3,故答案为:CaCO3、BaCO3;
(4)在第③步操作中,选择的除杂的试剂不能用KOH溶液代替NaOH溶液,若用KOH溶液代替除去粗盐中MgCl2的同时,还会引入难以除去的K+,使得氯化钠中混有氯化钾,故答案为:会引入K+;
(6)第⑥步操作加入适量盐酸时,盐酸与氢氧化钠和碳酸钠反应生成氯化钠,使得精盐的质量大于粗盐中NaCl的质量,故答案为:在提纯过程中生成了氯化钠。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】将X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,
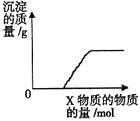
符合图中情况的一组物质是
A | B | C | D | |
X | Ba(HCO3)2 | Na2CO3 | KOH | CO2 |
Y | NaOH | CaCl2 | Mg(HSO4)2 | 石灰水 |
A.AB.BC.CD.D