题目内容
【题目】下列说法不正确的是( )
A. HClO、H2CO3、H2SO4、HClO4的酸性依次增强
B. 苹果酸![]() 含有1个手性碳原子
含有1个手性碳原子
C. HF、NH3、CH3OH均易溶于水的原因之一是与H2O分子均形成氢键
D. 以极性键结合的分子一定不是非极性分子
【答案】D
【解析】
A.HClO、H2CO3、H2SO4、HClO4中非羟基O原子个数增多,则酸性依次增强,故A正确;
B.若碳原子连有不同的四个基团,则为手性碳原子,由结构简式可知苹果酸分子中只含有1个手性碳原子(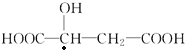 ),故B正确;
),故B正确;
C.HF、NH3、C2H5OH均易溶于水,是因为3种分子都能与H2O分子形成氢键,故C正确;
D.含有极性键的分子可能为极性分子,也可能为非极性分子,如甲烷为极性键构成的非极性分子,HCl为含极性键的极性分子,故D错误;
答案选D。

【题目】Ⅰ.某温度时,在一个10L的恒容容器中X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
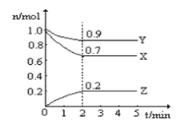
⑴该反应的化学方程式为___________;
⑵反应开始至2min,以气体Z表示的平均反应速率为___________;
⑶平衡时容器内混合气体密度比起始时_________(填“变大”,“变小”或“不变”下同),混合气体的平均相对分子质量比起始时___________;
⑷将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=__________。
Ⅱ.已知硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4= Na2SO4+ SO2↑+S↓+H2O,某学习小组探究一定条件下影响化学反应速率的因素,如下表所示:
⑸对比实验I、III可以得出的结论是______________,实验I、II探究的是___________的浓度越大,该反应速率越快,若实验III、IV也想得出同样结论,X=___________,Y= _________。
实验序号 | 温度 | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL-1) | V/mL | c/(molL-1) | V/mL | ||
I | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
II | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
III | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
IV | 35 | 5 | 0.2 | X | 0.2 | Y |