题目内容
3.将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)=XC(g)+2D(g),经过5min时,测得D的浓度为0.5mol/L,C(A):C(B)=3:5,C的反应速率是0.1mol/(L•min),求:(1)反应前A和B的物质的量
(2)B的反应速率;
(3)X的值.
分析 (1)根据D的浓度求出D的物质的量,根据方程式计算消耗A、B物质的量,再根据平衡时A、B浓度之比列方程计算A与B的起始物质的量;
(2)根据v=$\frac{△c}{△t}$计算v(B);
(3)根据反应速率之比等于化学计量数之比求出x值.
解答 解:(1)平衡时D的浓度为0.5mol/L,D的物质的量为2L×0.5mol/L=1mol,则:
3A(g)+B(g)=xC(g)+2D(g)
起始(mol):n n 0
变化(mol):1.5 0.5 1
平衡(mol):n-1.5 n-0.5
所以(n-1.5):(n-0.5)=3:5,解得n=3,
答:A、B起始物质的量为3mol;
(2)从开始到平衡时B的平均反应速率=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/L•min;
答:从开始到平衡时B的平均反应速率为0.05mol/L•min;
(3)反应速率之比等于化学计量数之比,所以v(B):v(C)=0.05 mol/(L.min):0.1mol/(L•min)=1:x,所以x=2.
答:x值是2.
点评 本题考查化学平衡有关计算,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
19.设NA为阿伏伽德罗常数,下列说法不正确的是( )
| A. | 含1 mol FeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 4.6 g Na与稀盐酸反应,转移电子数一定为0.2NA | |
| C. | 10.6 g Na2C03晶体中含CO${\;}_{3}^{2-}$数目为0.1NA | |
| D. | 常温下,22g CO2含碳氧双键数目为NA |
12.为了除去硝酸钾晶体中所含的Ca(NO3)2、K2SO4、MgSO4,现将其配成溶液,然后加入K2CO3、Ba(OH)2、HNO3等试剂,通过过滤、蒸发等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序准确的是( )
| A. | HNO3、K2CO3、Ba(OH)2 | B. | Ba(OH)2、HNO3、K2CO3 | ||
| C. | K2CO3、Ba(OH)2、HNO3 | D. | Ba(OH)2、K2CO3、HNO3 |
13.下列说法不正确的是( )
| A. | 符合通式:CnH2n-2的有机物可能是炔烃还可能是二烯烃和环烯烃 | |
| B. | 乙烯既能使酸性KmnO4溶液褪色,又能使溴水褪色,其褪色的反应原理相同 | |
| C. | 某烃分子中只含一个苯环且侧链全是烷烃基,则该烃必是苯的同系物 | |
| D. | 2-丁炔分子中的四个碳原子一定在同一条直线上 |
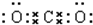 .
.
