题目内容
18.哈伯因发明了由氮气和氢气合成氨气的方法而获得 1918 年诺贝尔化学奖.其反应的化学方程式为N2+3H2$?_{高温高压}^{催化剂}$2NH3,在298K时:△H=-92.2kJ•mol-1.(1)在500℃下,合成塔中反应开始时氮气、氢气的浓度分别为1 mol•L-1、3mol•L-1,平衡时氢气的转化率为30%,则平衡时氨气的体积分数为$\frac{3}{17}$;此时将温度升高至 600℃,逆反应速率增大,正反应速率增大(填“增大”、“减小”或“不变”,下同),达到新平衡时氢气的转化率减小.
(2)在硝酸生产过程中所排放出来的气体含有 NO2会污染环境,现用氨催化还原法将 NO2转化为无毒气体直接排入空气中,写出有关反应的化学方程式:8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O.
分析 (1)相同条件下,气体摩尔体积相等,气体的物质的量之比等于其体积之比还等于其浓度之比,
N2+3H2$?_{高温高压}^{催化剂}$2NH3
开始(mol•L-1) 1 3 0
反应(mol•L-1) 0.3 3×30% 0.6
平衡(mol•L-1) 0.7 2.1 0.6
则平衡时混合气体浓度为(0.7+2.1+0.6)mol/L=3.4mol/L,
氨气的体积分数=$\frac{0.6mol/L}{3.4mol/L}×100%$;
升高温度,正逆反应速率都增大,平衡向吸热反应方向移动;
(2)根据题意知,在催化剂条件下,二氧化氮和氨气发生氧化还原反应生成氮气和水.
解答 解:(1)相同条件下,气体摩尔体积相等,气体的物质的量之比等于其体积之比还等于其浓度之比,
N2+3H2$?_{高温高压}^{催化剂}$2NH3
开始(mol•L-1) 1 3 0
反应(mol•L-1) 0.3 3×30% 0.6
平衡(mol•L-1) 0.7 2.1 0.6
则平衡时混合气体浓度为(0.7+2.1+0.6)mol/L=3.4mol/L,
氨气的体积分数=$\frac{0.6mol/L}{3.4mol/L}×100%$=$\frac{3}{17}$;
升高温度,活化分子百分数增大,导致正逆反应速率都增大,平衡向吸热反应方向移动,逆反应是吸热反应,所以平衡向逆反应方向移动,氢气的转化率减小,
故答案为:$\frac{3}{17}$;增大;减小;
(2)根据题意知,在催化剂条件下,二氧化氮和氨气发生氧化还原反应生成氮气和水,
反应方程式为8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O,故答案为:8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O.
点评 本题考查化学平衡有关计算、化学反应速率及化学平衡影响因素、化学方程式的书写等知识点,为高频考点,熟悉三段式解题方法是解本题关键,知道温度对反应速率影响原理,题目难度不大.

| A. | 25℃,由水电离出的c(H+)=10-11mol/L的溶液:Na+、K+、Cl-、ClO- | |
| B. | 与Al反应能放出氢气的溶液:Na+、Ba2+、NO3-、Cl- | |
| C. | 甲基橙变红的溶液:Na+、Mg2+、SO42-、Cl- | |
| D. | 含Al3+的溶液:K+、Ca2+、Cl-、S2- |

| A. | 图1:石油分馏 | B. | 图2:配制150mL 0.1mol/L盐酸 | ||
| C. | 图3:烧瓶内溶液变蓝色 | D. | 图4:探究NaHCO3的热稳定性 |
①2H2(g)+CO(g)?CH3OH(g〕
②2CH3OH(g)?CH3OCH3(g)+H20(g)
当达到平衡时实验数锯如表,下列分析正确的是( )
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②K值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
(1)甲烷是一种重要的清洁燃料
①甲烷燃烧放出大量的热,可直接作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1;请从化学反应的本质解释甲烷燃烧放出热量的原因:化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量.
②在甲烷燃料电池中,甲烷的化学能利用率大大提高.将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,其负极电极反应式是:CH4-8e-+10 OH-=CO32-+7H2O.
(2)二甲醚也是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.
①利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ/mol
该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是bd (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
②二甲醚也可以通过CH3OH分子间脱水制得
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
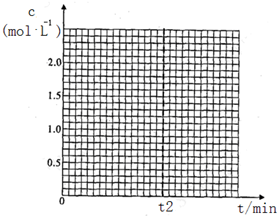
已知在280℃,体积不变的密闭容器中进行上述反应,t2时达到平衡,各组分起始和平衡浓度见下表.
| CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| 起始浓度 mol/L | 2.00 | 0.50 | 0 |
| 平衡浓度 mol/L | c1 | 1.00 | c2 |
在t2min内平均反应速率v(H2O)=$\frac{1}{2{t}_{2}}$mol/(L.min).
②若在400℃,相同的密闭容器中进行上述反应,请在下图中画出CH3OCH3浓度随时间变化的关系图(要求同时画出280℃的,并做好标注).
Ⅰ.(1)甲烷自热重整是一种先进的制氢方法,其反应方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)
阅读下图,计算该反应的反应热△H=+161.1kJ/mol.

(2)以CH4、O2为原料,100mL0.15mol/LNaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
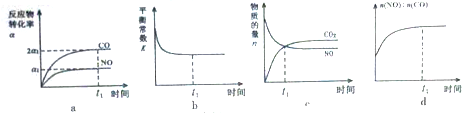
Ⅱ.一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是AD(选填字母).
Ⅲ.相同温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | C1 | C2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
(1)n=19.6kJ.
(2)若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol•L-1•s-1.
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 | |
| B. | MgCO3$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| C. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| D. | SiO2$\stackrel{HCl}{→}$SiCl4$\stackrel{H_{2}}{→}$Si |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |