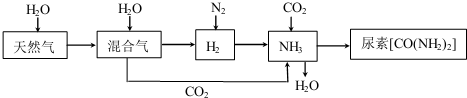
题目内容
20.A、B、C、D、E为物种短周期元素,A、B、C是原子序数递增的同周期元素,且最外层电子数之和为15,A与C可形成常见的AC2分子,D元素的某种原子中无中子,E是地壳中含量最高的金属元素.请回答下列问题:(1)AC2分子的电子式为
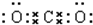 .
.(2)比较BD3与D2C的稳定性:H2O比NH3稳定(填化学式).
(3)五种元素的原子半径由大到小的顺序是Al>C>N>O>H(填元素符号).
(4)E的单质与NaOH溶液反应生成的盐的涪液与少量AC2反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(5)化合物EB溶于强碱生成氨气,写出EB与NaOH溶液反应的化学方程式AlN+NaOH+H2O=NH3↑+NaAlO2.
(6)工业生产的EB产品往往含有碳和氧化铝杂质,现取10g样品置于反应器中,通入2.016L(标准状况下)O2,在高温下充分反应后,所得气体的密度是相同状况下氢气的15倍(EB不与O2反应),该样品中含杂质碳的质量分数为19.2%.
分析 D元素的某种原子中无中子,则D为H元素;E是地壳中含量最高的金属元素,则E为Al元素;A与C可形成常见的AC2分子,若C为-1价,则A为+2价,C的最外层含有7个电子、A最外层含有2个电子,则B最外层含有电子数为:15-7-2=6,不满足A、B、C是原子序数递增的同周期元素;当C为-2价时,A为+4价,则C最外层含有6个电子、A最外层含有4个电子,C最外层含有6个电子,B最外层电子数为:15-4-6=5,则同一周期中A、B、C是原子序数递增,符合条件,所以A为C、B为N、C为O元素,据此进行解答.
解答 解:D元素的某种原子中无中子,则D为H元素;E是地壳中含量最高的金属元素,则E为Al元素;A与C可形成常见的AC2分子,若C为-1价,则A为+2价,C的最外层含有7个电子、A最外层含有2个电子,则B最外层含有电子数为:15-7-2=6,不满足A、B、C是原子序数递增的同周期元素;当C为-2价时,A为+4价,则C最外层含有6个电子、A最外层含有4个电子,C最外层含有6个电子,B最外层电子数为:15-4-6=5,则同一周期中A、B、C是原子序数递增,符合条件,所以A为C、B为N、C为O元素,
(1)AC2为CO2,二氧化碳为共价化合物,其分子中含有2个碳氧双键,则二氧化碳的电子式为: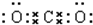 ,
,
故答案为: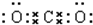 ;
;
(2)BD3为NH3,D2C为H2O,元素的非金属性越强,对应的氢化物越稳定,非金属性O>N,则稳定性:H2O>NH3,
故答案为:H2O;NH3;
(3)原子的电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则五种元素的原子半径由大到小的顺序是:Al>C>N>O>H,
故答案为:Al>C>N>O>H;
(4)E的单质为Al,Al与NaOH溶液反应生成的盐为偏铝酸钠,偏铝酸钠溶液与少量AC2反应生成氢氧化铝沉淀和碳酸钠,反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(5)化合物EB为AlN,AlN溶于强碱生成氨气,铝元素应该转化成偏铝酸钠,则AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NH3↑+NaAlO2,
故答案为:AlN+NaOH+H2O=NH3↑+NaAlO2;
(6)气体产物的平均摩尔质量=2g/mol×15=30g/mol<44g/mol,说明氧气不足,生成气体是CO和CO2混合气体,设CO与CO2的物质的量分别为x、y,氧气的物质的量为:$\frac{2.016L}{22.4L/mol}$=0.09mol,则①$\frac{28x+44y}{x+y}$=30,根据氧元素守恒可得:②x+2y=0.09mol×2,联立①②可得:x=0.14mol、y=0.02mol,
根据碳元素质量可知样品中含有碳的质量为:(0.02mol+0.02mol×7)×12g/mol=1.92g,含有碳的质量分数为:$\frac{1.92g}{10g}$×100%=19.2%,
故答案为:19.2%.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题知识点较多、综合性较强,充分考查了学生的分析能力及化学计算能力.

 每课必练系列答案
每课必练系列答案
| A. | ①所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | ②表明合成氨反应是放热反应,a表示在反应体系中加入了催化剂 | |
| C. | ③所示,t1℃时质量分数均为20%的甲、乙两种饱和溶液,升温到t2℃时,两种溶液中溶质的质量分数不再相等 | |
| D. | ④所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |

| A. | 图1:石油分馏 | B. | 图2:配制150mL 0.1mol/L盐酸 | ||
| C. | 图3:烧瓶内溶液变蓝色 | D. | 图4:探究NaHCO3的热稳定性 |
①2H2(g)+CO(g)?CH3OH(g〕
②2CH3OH(g)?CH3OCH3(g)+H20(g)
当达到平衡时实验数锯如表,下列分析正确的是( )
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②K值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |