题目内容
9.为达到预期的实验目的,下列方法可行的是( )| A. | 用溶解、过滤的方法提纯含有少量碳酸镁的氢氧化镁 | |
| B. | 向混有乙酸的乙酸乙酯中加入NaOH溶液再分液提纯乙酸乙酯 | |
| C. | 除去FeCl2中少量的FeBr2:加入适量氯水,在加四氯化碳萃取、分液 | |
| D. | 向AlCl3溶液中滴加氨水,产生白色沉淀,再加入NaHSO4溶液,沉淀消失 |
分析 A.碳酸镁、氢氧化镁均不溶于水;
B.乙酸乙酯与NaOH反应;
C.加入适量氯水,可将亚铁离子氧化;
D.滴加氨水,产生白色沉淀为氢氧化铝,可溶解在NaHSO4溶液中.
解答 解:A.碳酸镁、氢氧化镁均不溶于水,则不能利用过滤法分离,故A错误;
B.乙酸乙酯与NaOH反应,将原物质除去,应选饱和碳酸钠溶液除杂,故B错误;
C.加入适量氯水,可将亚铁离子氧化,不能除杂,故C错误;
D.滴加氨水,产生白色沉淀为氢氧化铝,可溶解在NaHSO4溶液中,则沉淀消失,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、物质的性质及反应现象等,把握物质的性质、发生的反应为解答的关键,侧重元素化合物知识及分析应用能力的综合考查,题目难度不大.

练习册系列答案
相关题目
19. 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:Y>Z>X | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | X与R的核电荷数相差24 |
14.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,4.4 g乙醛所含σ键数目为0.7NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
1.室温下向10mL 0.1 mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法正确的是( )
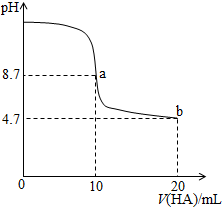

| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(A-)>c(HA) |
18.下列有机物的命名错误的是( )
| A. |  1,2,4-三甲苯 | B. |  3-甲基戊烯 | C. |  2-甲基-1-丙醇 | D. |  1,3-二溴丙烷 |
10.氢氧化锂(LiAlH4)既是金属储氢材料又是有机合成中常用的试剂,溶于适量的水可得到无色溶液:LiAlH4+2H2O═LiAlO2+4H2↑,在125℃分解为LiH、H2和Al.下列说法不正确的是( )
| A. | LiAlH4中H元素的化合价为-1 | |
| B. | LiAlH4L、iAlO2、LiH均是离子化合物 | |
| C. | 1mol LiAlH4在125℃完全分解,转移4mol电子 | |
| D. | 0.5 mol LiAlH4与水充分反应后产生44.8L H2 |