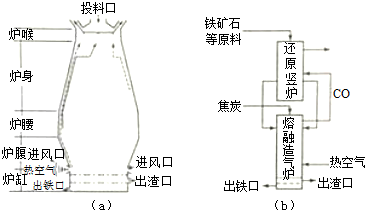
题目内容
14.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,4.4 g乙醛所含σ键数目为0.7NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
分析 A、H218O与D2O的摩尔质量均为20g/mol;
B、求出乙醛的物质的量,然后根据1mol乙醛中含6molσ键来分析;
C、求出二氧化碳的物质的量,然后根据CO2与足量Na2O2的反应为歧化反应来分析;
D、二氧化锰只能与浓盐酸反应,稀盐酸和二氧化锰不反应.
解答 解:A、H218O与D2O的摩尔质量均为20g/mol,故2.0gH218O与D2O混合物的物质的量为0.1mol,而1molH218O与D2O中均含10mol中子,故0.1molH218O与D2O混合物中含1mol中子,即NA个,故A正确;
B、4.4g乙醛的物质的量为0.1mol,而1mol乙醛中含6molσ键,故0.1mol乙醛中含0.6molσ键,即0.6NA个,故B错误;
C、标况下,5.6L二氧化碳的物质的量为0.25mol,而CO2与足量Na2O2的反应为歧化反应,1mol二氧化碳发生反应时反应转移1mol电子,故0.25mol二氧化碳反应时此反应转移0.25mol电子,即0.25NA个,故C错误;
D、二氧化锰只能与浓盐酸反应,一旦浓盐酸变稀,反应即停止,4molHCl反应时转移2mol电子,而50mL12mol/L盐酸的物质的量n=CV=12mol/L×0.05L=0.6mol,这0.6mol盐酸不能完全反应,则转移的电子的物质的量小于0.3mol电子,即小于0.3NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
5.下列有机物其一氯代物的结构可能只有一种的是( )
| A. | C2H6 | B. | C3H8 | C. | C4H10 | D. | C5H12 |
9.为达到预期的实验目的,下列方法可行的是( )
| A. | 用溶解、过滤的方法提纯含有少量碳酸镁的氢氧化镁 | |
| B. | 向混有乙酸的乙酸乙酯中加入NaOH溶液再分液提纯乙酸乙酯 | |
| C. | 除去FeCl2中少量的FeBr2:加入适量氯水,在加四氯化碳萃取、分液 | |
| D. | 向AlCl3溶液中滴加氨水,产生白色沉淀,再加入NaHSO4溶液,沉淀消失 |
6.已知丙烷的燃烧热△H=-2215kJ•mol-1.若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( )
| A. | 55kJ | B. | 220kJ | C. | 550kJ | D. | 1108kJ |
15.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
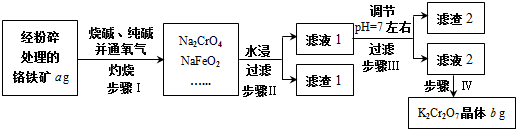
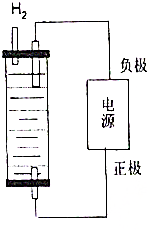 制取漂白粉的氯气通过电解饱和食盐水得到.
制取漂白粉的氯气通过电解饱和食盐水得到.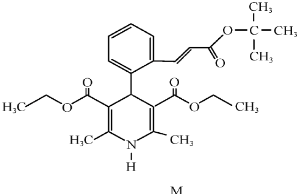
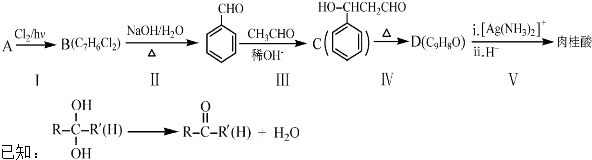
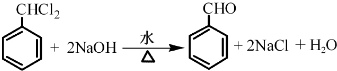 .
.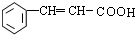 .
.