题目内容
1.室温下向10mL 0.1 mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法正确的是( )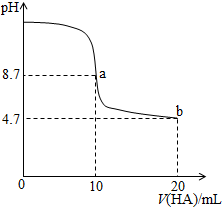
| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(A-)>c(HA) |
分析 A.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性;
B.b点时HA过量,溶液呈酸性,HA电离出H+,抑制水的电离;
C.pH=7时,c(H+)=c(OH-),结合电荷守恒判断;
D.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于A-水解程度.
解答 解:A.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性,应为c(HA)>c(H+),故A错误;
B.a点A-水解,促进水的电离,b点时HA过量,溶液呈酸性,HA电离出H+,抑制水的电离,故B错误;
C.pH=7时,c(H+)=c(OH-),由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)=c(A-),故C错误;
D.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于A-水解程度,则存在c(A-)>c(HA),故D正确.
故选D.
点评 本题为2015年考题,侧重于酸碱混合的定性判断,有利于培养学生的分析能力和良好的科学素养,题目难度中等,本题易错点为C,注意从溶液电中性的角度分析.

练习册系列答案
相关题目
12.关于下列图示的说法中正确的是( )
| A. |  用图1装置除去HCl中少量的Cl2 | |
| B. |  用图2装置蒸干Al2(SO4)3饱和溶液制取无水Al2(SO4)3 | |
| C. |  图3制备并收集少量NO2 | |
| D. |  图4是原电池装置,Fe电极为阴极 |
9.为达到预期的实验目的,下列方法可行的是( )
| A. | 用溶解、过滤的方法提纯含有少量碳酸镁的氢氧化镁 | |
| B. | 向混有乙酸的乙酸乙酯中加入NaOH溶液再分液提纯乙酸乙酯 | |
| C. | 除去FeCl2中少量的FeBr2:加入适量氯水,在加四氯化碳萃取、分液 | |
| D. | 向AlCl3溶液中滴加氨水,产生白色沉淀,再加入NaHSO4溶液,沉淀消失 |
6.已知丙烷的燃烧热△H=-2215kJ•mol-1.若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( )
| A. | 55kJ | B. | 220kJ | C. | 550kJ | D. | 1108kJ |
2.关于下列装置的叙述正确的是( )
 |  |  |  |
| ① | ② | ③ | ④ |
| A. | 装置①可用于模拟氯碱工业生产氯气 | |
| B. | 装置②的原理可用于潮汐能发电站钢阀门的保护 | |
| C. | 装置③可用于食盐水的蒸发结晶 | |
| D. | 装置④可用于二氧化锰与浓盐酸反应制取氯气 |


 ;
; )中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②;
)中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②; .
.
