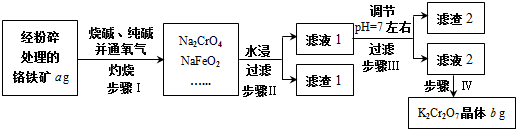
题目内容
19.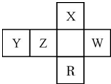 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:Y>Z>X | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | X与R的核电荷数相差24 |
分析 由短周期元素在周期表中的位置可知,X处于第二周期,Y、Z、W处于第三周期,R处于第四周期,W原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则W为S,可推知X为N,Y为Al,Z为Si,R为As.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大;
B.AlCl3溶液显酸性;
C.同周期自左而右元素非金属性增强,非金属性越强,氢化物越稳定;
D.X与R的核电荷数之差为第三、第四周期容纳元素种数之和.
解答 解:由短周期元素在周期表中的位置可知,X处于第二周期,Y、Z、W处于第三周期,R处于第四周期,W原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则W为S,可推知X为N,Y为Al,Z为Si,R为As.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,则原子半径:Y>Z>X,故A正确;
B.Y为Al元素,NaAlO2溶液显碱性,而AlCl3溶液显酸性,故B正确;
C.同周期自左而右元素非金属性增强,故非金属性W>Z,非金属性越强,氢化物越稳定,则最简单气态氢化物的热稳定性为W>Z,故C错误;
D.X与R的核电荷数之差为第三、四周期容纳元素种数之和,即二者核电荷数之差为8+18=26,故D错误,
故选:AB.
点评 本题考查结构性质位置关系应用,W为推断的突破口,侧重元素周期律的考查,注意理解同主族元素原子序数关系,题目难度不大.

练习册系列答案
相关题目
9.下列反应,改变反应物用量后仍能用同一个离子方程式表示的是 ( )
| A. | NaHSO4溶液与Ba(OH)2溶液反应 | B. | C6H5ONa溶液与CO2反应 | ||
| C. | NaAlO2溶液与CO2反应 | D. | Fe与稀硝酸反应 |
9.为达到预期的实验目的,下列方法可行的是( )
| A. | 用溶解、过滤的方法提纯含有少量碳酸镁的氢氧化镁 | |
| B. | 向混有乙酸的乙酸乙酯中加入NaOH溶液再分液提纯乙酸乙酯 | |
| C. | 除去FeCl2中少量的FeBr2:加入适量氯水,在加四氯化碳萃取、分液 | |
| D. | 向AlCl3溶液中滴加氨水,产生白色沉淀,再加入NaHSO4溶液,沉淀消失 |
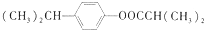
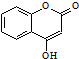 是一种医药中间体.常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体.常用来制备抗凝血药,可通过下列路线合成:
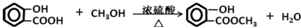
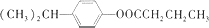
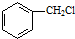 和乙醇为原料,制备
和乙醇为原料,制备 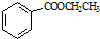 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.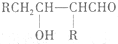 $\stackrel{△}{→}$
$\stackrel{△}{→}$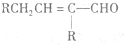 兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸
兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸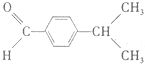 合成兔耳草醛的路线如下:
合成兔耳草醛的路线如下: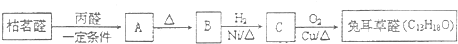
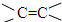 、
、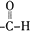 (写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热
(写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热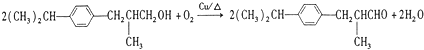 .
. 、
、 .
.