题目内容
【题目】利用硫铁矿烧渣(主要成分为Fe2O3,还含有少量Al2O3、 MgO、SiO2等杂质)制备铁红工艺流程如下:

回答下列问题:
(1)还原焙烧后,Fe元素的化合价为__________。
(2)“酸浸”实验中,需加入絮凝剂沉淀杂质。絮凝剂用量和过滤时间对铁红成份的影响如下表所示。由表可知,所采用的最佳实验条件为__________(填序号)。
序号 | 絮凝剂用量/×10-6t | 过滤时间/min | Fe2O3含量% | SiO2含量% |
① | 40 | 5 | 96.5 | 0.12 |
② | 50 | 10 | 97.9 | 0.10 |
③ | 60 | 20 | 98.3 | 0.07 |
④ | 100 | 40 | 99.4 | 0.01 |
⑤ | 150 | 150 | 99.5 | 0.008 |
(3)若“合成”中c(Mg2+)=0.01mol/L,加入NH4HCO3(设溶液体积增加1倍),当Fe2+恰好沉淀完全时,溶液中c(Fe2+)=1.0×10-5mol/L,此时是否有MgCO3沉淀生成?__________(列式计算)。FeCO3、MgCO3的Ksp分别为3.2×10-11、3.0×10-8。
(4)“合成”过程中发生反应的离子方程式为_____________。
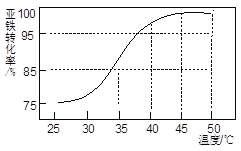
(5)“合成”过程中温度对亚铁离子转化率的影响如下图,分析选择反应温度为40℃的原因是________。
(6)“煅烧”中由FeCO3制备Fe2O3的化学方程式为________。
(7)本流程中,铝元素是以________(填化学式)形式被除去的。
【答案】 +2 ④ 无沉淀生成 c(CO32-)=Ksp(FeCO3)/c(Fe2+)=3.2×10-11/10-5=3.2×10-6 (1分)
Q= c(CO32-)×c(Mg2+)=3.2×10-6×0.01/2< Ksp(MgCO3) Fe2++2HCO3-=FeCO3↓+H2O+CO2↑ 温度低于40℃,亚铁离子转化率较低。温度高于40℃,亚铁离子转化率变化不大。温度过高,碳酸氢铵易分解 4FeCO3 +O2![]() 2Fe2O3+ 4CO2 Al(OH)3
2Fe2O3+ 4CO2 Al(OH)3
【解析】考查化学工艺流程,(1)根据金属的冶炼,炭黑能够还原Fe2O3,因为酸浸中加入硫酸,如果还原时铁元素转化成铁单质,会与硫酸反应生成H2,H2可燃性气体,可能发生危险,因此还原焙烧后,铁元素的化合价为+2价;(2)由表中数据可得虽然絮凝剂用量越多、过滤时间越长,Fe2O3含量越高、SiO2含量越低,但是1.0×10-4t、40min条件与1.5×10-4t、150min条件相比,前者Fe2O3含量只比后者低0.1个百分点,SiO2含量高0.002个百分点,而絮凝剂用量和过滤时间,前者比后者明显少,所以应选择最佳实验条件为④;(3)c(CO32-)=Ksp(FeCO3)/c(Fe2+)=3.2×10-11/10-5=3.2×10-6 ,Q= c(CO32-)×c(Mg2+)=3.2×10-6×0.01/2< Ksp(MgCO3) ,因此无沉淀产生;(4)结合流程并根据题意,向含Fe2+的溶液中加入NH4HCO3,生成了FeCO3沉淀,根据原子守恒和电荷守恒,还应生成H2O和CO2,故“合成”过程中发生反应的离子方程式为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑;(5)根据图像,温度低于40℃,亚铁离子转化率较低。温度高于40℃,亚铁离子转化率变化不大;温度过高,碳酸氢铵易分解;(6)在空气中煅烧FeCO3,FeCO3分解,+2价铁会被氧化成+3价铁的化合物,所以生成物为:Fe2O3和CO2,故“煅烧”中由FeCO3制备Fe2O3的化学方程式为:4FeCO3+O2![]() 2Fe2O3+4CO2;(7)本流程中酸浸时Al2O3转变为Al3+,加NH4HCO3时,Al3+会与HCO3-发生双水解转变为Al(OH)3,由此可得铝元素是以Al(OH)3形式被除去的。
2Fe2O3+4CO2;(7)本流程中酸浸时Al2O3转变为Al3+,加NH4HCO3时,Al3+会与HCO3-发生双水解转变为Al(OH)3,由此可得铝元素是以Al(OH)3形式被除去的。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】一氯甲烷是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
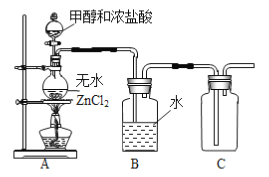
(1)某小组同学在实验室用如图所示装置模拟催化法制备和收集一氯甲烷。
①无水ZnCl2为催化剂,圆底烧瓶中发生反应的化学方程式为___________,如果实验时圆底烧瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是____________。
②装置B的主要作用是____________。
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1 mL c1 mol·L-1 NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol·L-1盐酸标准液对吸收液进行返滴定,最终消耗V2 mL盐酸。则所收集CH3Cl的物质的量为________mol。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
(2)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子。相关数据如下表:
化学键 | C—Cl | C—Br |
键能(kJ·mol-1) | 330 | 276 |
化合物 | AgCl | AgBr |
Ksp | 1.8×10-10 | 5×10-13 |
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式______________。
②CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因__________________。
③设计实验证明Ksp(AgCl)>Ksp(AgBr):___________(简要说明实验操作、现象和结论)。
【题目】为除去某物质中所含的杂质,周佳敏同学做了以下四组实验,其中她所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
A.①②③
B.②③④
C.①③④
D.①②③④