题目内容
9.下列说法正确的是( )| A. | 所有烷烃分子中均含有碳碳单键 | |
| B. | 苯及其同系物、醇类和羧酸都能发生取代反应 | |
| C. | 大气臭氧层的破坏主要与氟氯烃的氟原子有关 | |
| D. | 氨基酸与酸、碱都能发生反应生成盐 |
分析 A.甲烷中只含有1个C;
B.苯以及同系物均能发生取代反应,醇类和羧酸能发生酯化反应;
C.氟氯烃等制冷剂的大量排放,是造成臭氧层破坏的主要原因;
D.氨基酸为两性化合物.
解答 解:A、甲烷中只含有C-H键,故A错误;
B、苯与液溴取代生成溴苯,甲苯与溴反应生成三溴甲基、羧酸与醇可以发生酯化反应,也为取代反应,故B正确;
C、氟氯烃等制冷剂的大量排放,是造成臭氧层破坏的主要原因,即与氟原子和氯原子均有关,故C错误;
D、氨基酸中含有-COOH和-NH,Wie两性化合物,既能与酸反应也能与碱反应,故D正确,故选BD.
点评 本题主要考查的是甲烷的构成、取代反应的定义、氨基酸的性质,难度不大.

练习册系列答案
相关题目
19.天然产物水有关解的叙述不正确的是( )
| A. | 油脂水解可得到丙三醇 | |
| B. | 可用碘检验淀粉是否发生水解 | |
| C. | 蛋白质水解的最终产物均为氨基酸 | |
| D. | 纤维素水解与淀粉水解得到的最终产物相同 |
20.工业合成氨与制备硝酸一般可连续生产,流程如图1:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,
NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,科学家利用该反应的原理,设计成氨气--氧气燃料电池,则通入氨气的电极是:负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,科学家利用该反应的原理,设计成氨气--氧气燃料电池,则通入氨气的电极是:负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
1.下列说法正确的是( )
| A. | 将纤维素和硫酸加热水解后的液体取出少许,加入新制的Cu(OH)2悬浊液,并加热,若有红色沉淀生成,证明纤维素水解生成了葡萄糖 | |
| B. | 蛋白质溶液中加入甲醛可以使蛋白质从溶液中析出,加水又溶解 | |
| C. | 蔗糖和麦芽糖互为同分异物体,它们均能发生银镜反应 | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸(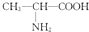 )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
18.已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列叙述中正确的是( )
| A. | 常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 | |
| D. | 向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
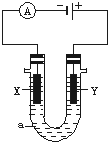 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: .
. .
.