题目内容
20.工业合成氨与制备硝酸一般可连续生产,流程如图1: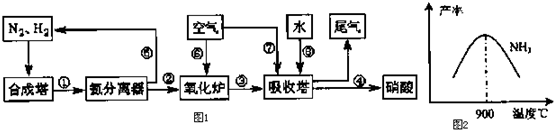
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,科学家利用该反应的原理,设计成氨气--氧气燃料电池,则通入氨气的电极是:负极 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
分析 (1)根据平衡常数表达式结合三行式计算化学平衡常数;
(2)对于放热反应,温度越高,K越小,反之越大;
(3)对于放热反应,温度升高,则化学平衡向逆向移动;
(4)根据盖斯定律来计算反应的焓变,进而书写热化学方程式;
(5)氨气在纯氧中燃烧,生成氮气和水,燃料电池中,燃料做负极.
解答 解:(1)C0+H2O(g)?CO2+H2,
初始浓度:0.2 0.3 0 0
变化浓度:0.12 0.12 0.12 0.12
平衡浓度:0.08 0.28 0.12 0.12
化学平衡常数K=$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.12×0.12}{0.08×0.28}$=1,
故答案为:1;
(2)该反应是放热反应,对于放热反应,温度越高,K越小,T1<573K,
故答案为:<;
(3)对于放热反应,温度升高,则化学平衡向逆向移动,所以氨气的产率减小,
故答案为:温度高于900℃时,平衡向左移动;
(4)根据题意:①$\frac{1}{2}$CH4(g)+2NO2(g)═2NO(g)+$\frac{1}{2}$CO2(g)+H2O(g)△H=$\frac{1}{2}$×(-574kJ•mol-1)=-287kJ•mol-1;
$\frac{1}{2}$CH4(g)+2NO(g)═N2(g)+$\frac{1}{2}$CO2(g)+H2O(g)△H=$\frac{1}{2}$×(-1160kJ•mol-1)=-580kJ•mol-1;
根据盖斯定律反应CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)可以看成是①+②,所以△H=-287kJ•mol-1-580kJ•mol-1=-867kJ•mol-1,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(5)氨气在纯氧中燃烧,生成氮气和水,化学方程式为:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O,在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-→N2+6H2O,
故答案为:4NH3+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2N2+6H2O;负极;2NH3-6e-+6OH-=N2+6H2O.
点评 本题是一道工业合成氨的综合性知识题目,可以根据所学知识进行回答,难度较大.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. | 所有糖类物质都有甜味,但不一定都溶于水 | |
| B. | 石油的分馏是化学变化 | |
| C. | 石油的分馏实验中,温度计水银球插入液面以下,因为它测的是混合液的温度 | |
| D. | 葡萄糖和果糖性质不同,但分子式相同,属于同分异构体 |
| A. | 决定反应速率的因素是反应物的浓度 | |
| B. | 在金厲钠与足量水反应中,增加水的量能加快反应速率 | |
| C. | 在可逆反应中,反应物不可能完全转化为生成物 | |
| D. | 可逆反应达到平衡时,正、逆反应速率相等且等于零 |
| A. | 二甲醚与乙醇是同分异构体 | |
| B. | 该燃料电池中通入二甲醚的一极为正极 | |
| C. | 二甲醚作为汽车燃料不会产生氮的氧化物和碳氢化合物的污染 | |
| D. | 在燃料电池中二甲醚最终转化为CO2和H2O |
| A. | 2-甲基丙烷 | B. | 异戊烷 | C. | 2,2-二甲基丁烷 | D. | 2,2-二甲基丙烷 |
| A. | 铝和盐酸反应 | B. | 焦炭和二氧化碳共热 | ||
| C. | 石灰石的分解 | D. | 氢气还原氧化铜 |
| A. | 所有烷烃分子中均含有碳碳单键 | |
| B. | 苯及其同系物、醇类和羧酸都能发生取代反应 | |
| C. | 大气臭氧层的破坏主要与氟氯烃的氟原子有关 | |
| D. | 氨基酸与酸、碱都能发生反应生成盐 |
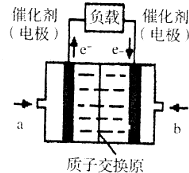 氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:
氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:2H2-4e-═4H+
O2+4e-+4H+═2H2O
下列说法不正确的是( )
| A. | 右电极为电池正极,b处通入的物质是氧气 | |
| B. | 左电极为电池负极,a处通入的物质是氧气 | |
| C. | H2在负极发生氧化反应 | |
| D. | 供电时的总反应为:2H2+O2=2H2O |