题目内容
18.已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列叙述中正确的是( )| A. | 常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 | |
| D. | 向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
分析 A.KSP只与温度有关,温度不变,则难溶物的溶度积不变;
B.溶度积越小,易溶于生成沉淀;
C.Qc与KSP差别越大,越容易生成沉淀;
D.向AgCl的饱和溶液中加入NaCl晶体,溶解平衡逆向移动,生成沉淀,c(Ag+)减小,c(Cl-)增大.
解答 解:A.KSP只与温度有关,与溶液中离子浓度无关,温度不变,则溶度积不变,故A错误;
B.KSP(AgCl)>KSP(AgI),沉淀转化为溶解度更小的物质容易发生,向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色,故B正确;
C.KCl和KI的混合溶液中,c(Cl-)和c(I-)的大小无法比较,所以Qc也无法知道,无法判断Qc与KSP差别大小,也就无法确定沉淀的先后顺序,故C错误;
D.向AgCl的饱和溶液中加入NaCl晶体,溶解平衡逆向移动,生成沉淀,c(Ag+)减小,c(Cl-)增大,c(Ag+)<c(Cl-),故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,题目难度中等,注意难溶物类型相同时,溶度积越小越容易生成沉淀,注意掌握难溶物溶解平衡及其影响因素,试题侧重考查学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列有关化学反应速率和限度的说法中,正确的是( )
| A. | 决定反应速率的因素是反应物的浓度 | |
| B. | 在金厲钠与足量水反应中,增加水的量能加快反应速率 | |
| C. | 在可逆反应中,反应物不可能完全转化为生成物 | |
| D. | 可逆反应达到平衡时,正、逆反应速率相等且等于零 |
9.下列说法正确的是( )
| A. | 所有烷烃分子中均含有碳碳单键 | |
| B. | 苯及其同系物、醇类和羧酸都能发生取代反应 | |
| C. | 大气臭氧层的破坏主要与氟氯烃的氟原子有关 | |
| D. | 氨基酸与酸、碱都能发生反应生成盐 |
6.下列操作或装置能达到实验目的是( )

| A. | ①④ | B. | ②④ | C. | ②③ | D. | ①③ |
13.实验室用如图所示的装置制取乙酸乙酯,下列说法中,不正确的是( )


| A. | 及时将乙酸乙酯蒸出,平衡向生成乙酸乙酯的方向移动 | |
| B. | 向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| C. | 试管b中导气管下端不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| D. | 反应结束后用分液的方法分离试管b中的混合液 |
3.咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为: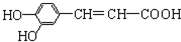 下列有关咖啡酸的说法中,不正确的是( )
下列有关咖啡酸的说法中,不正确的是( )
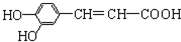 下列有关咖啡酸的说法中,不正确的是( )
下列有关咖啡酸的说法中,不正确的是( )| A. | 1mol咖啡酸可与3mol NaOH发生反应 | |
| B. | 咖啡酸可以发生还原、酯化、加聚、显色等反应 | |
| C. | 1mol咖啡酸可与4mol Br2发生反应 | |
| D. | 1mol咖啡酸最多可与5mol H2发生加成反应 |
10.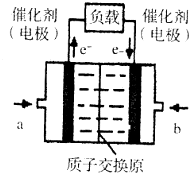 氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:
氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:
2H2-4e-═4H+
O2+4e-+4H+═2H2O
下列说法不正确的是( )
 氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:
氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:2H2-4e-═4H+
O2+4e-+4H+═2H2O
下列说法不正确的是( )
| A. | 右电极为电池正极,b处通入的物质是氧气 | |
| B. | 左电极为电池负极,a处通入的物质是氧气 | |
| C. | H2在负极发生氧化反应 | |
| D. | 供电时的总反应为:2H2+O2=2H2O |
7.下列事实能用同一原理解释的是( )
| A. | 溴乙烷、乙酸都能与NaOH水溶液反应 | |
| B. | 乙酸乙酯、乙酸钠都能与稀硫酸反应 | |
| C. | 福尔马林、葡萄糖与新制Cu(OH)2共热都有红色沉淀生成 | |
| D. | 乙烯、乙醛都能使溴水褪色 |
8.能用浓硫酸干燥的一组气体是( )
| A. | H2和NH3 | B. | H2,SO2和CO | C. | H2S和SO2 | D. | NH3,H2S和SO2 |