题目内容
17.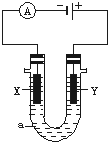 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为2H++2e-=H2↑.在X极附近观察到的现象是放出气体,溶液变红.
②Y电极上的电极反应式为2Cl--2e-=Cl2↑,检验该电极反应产物的方法是把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色.
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:X电极的材料是纯铜,电极反应式为Cu2++2e-=Cu.
(3)若X、Y都是惰性电极,a是1mol•L-1盐酸溶液,实验开始10min后,盐酸浓度为0.6mol•L-1,则反应开始至10min,HCl的反应速率v(HCl)=0.04 mol•L-1•min-1.
分析 (1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,氯气能使湿润的碘化钾淀粉试纸变蓝;
(2)电解方法精炼粗铜,粗铜做阳极,精铜做阴极,含铜离子的盐溶液做电解质溶液;
(3)根据化学反应速率概念计算V=$\frac{△c}{△t}$计算.
解答 解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,故答案为:2H++2e-=H2↑;放出气体,溶液变红;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,氯气能使湿润的碘化钾淀粉试纸变蓝,可以用于氯气的检验,
故答案为:2Cl--2e-=Cl2↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色;
(2)电解方法精炼粗铜,电解质溶液a选用CuSO4溶液,阳极Y为粗铜,阴极x为纯铜,铜离子得到电子生成铜,电极反应为Cu2++2e-=Cu;故答案为:纯铜,Cu2++2e-=Cu;
(3)乙装置中X、Y都是惰性电极,a是1mol•L-1盐酸溶液,实验开始10min后,盐酸溶液浓度为0.6mol•L-1,则反应开始至10min,盐酸溶液的反应速率=$\frac{1mol/L-0.6mol/L}{10min}$=0.04mol•L-1•min-1;
故答案为:0.04 mol•L-1•min-1.
点评 本题考查了原电池、电解池原理的分析应用,主要是电极反应,电极产物判断,掌握基础是关键,题目难度中等.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
7.向体积为 Va 的0.05mol•L-1CH3COOH溶液中加入体积为Vb的0.05mol•L-1KOH溶液,下列关系错误的是( )
| A. | Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+) | |
| B. | Va=Vb时:c(CH3COOH)+c(H+)>c(OH-) | |
| C. | Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+) | |
| D. | Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
8.下列有关化学反应速率和限度的说法中,正确的是( )
| A. | 决定反应速率的因素是反应物的浓度 | |
| B. | 在金厲钠与足量水反应中,增加水的量能加快反应速率 | |
| C. | 在可逆反应中,反应物不可能完全转化为生成物 | |
| D. | 可逆反应达到平衡时,正、逆反应速率相等且等于零 |
5.下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A. | 2-甲基丙烷 | B. | 异戊烷 | C. | 2,2-二甲基丁烷 | D. | 2,2-二甲基丙烷 |
12.下列属于放热反应的是( )
| A. | 铝和盐酸反应 | B. | 焦炭和二氧化碳共热 | ||
| C. | 石灰石的分解 | D. | 氢气还原氧化铜 |
9.下列说法正确的是( )
| A. | 所有烷烃分子中均含有碳碳单键 | |
| B. | 苯及其同系物、醇类和羧酸都能发生取代反应 | |
| C. | 大气臭氧层的破坏主要与氟氯烃的氟原子有关 | |
| D. | 氨基酸与酸、碱都能发生反应生成盐 |
6.下列操作或装置能达到实验目的是( )

| A. | ①④ | B. | ②④ | C. | ②③ | D. | ①③ |
7.下列事实能用同一原理解释的是( )
| A. | 溴乙烷、乙酸都能与NaOH水溶液反应 | |
| B. | 乙酸乙酯、乙酸钠都能与稀硫酸反应 | |
| C. | 福尔马林、葡萄糖与新制Cu(OH)2共热都有红色沉淀生成 | |
| D. | 乙烯、乙醛都能使溴水褪色 |
