题目内容
19.溴单质具有广泛的工业价值,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性.某化学小组模拟工业流程从浓缩的海水中提取液溴,主要实验装置(夹持装置略去)及操作步骤如图: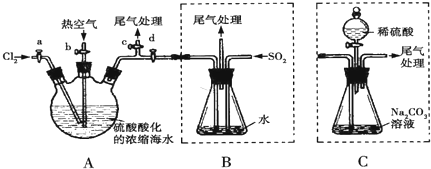
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤①②的同时,向B中通入足量SO2;
④关闭b阀,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴.
请回答:
(1)本实验中所用的稀硫酸需要用物质的量浓度18.4mol/L的浓硫酸配制,若要配制500mL1mol/L的H2SO4溶液,则需要此浓硫酸27.2mL,若配制过程中遇到下列情况,对硫酸的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)未经冷却将溶液注入容量瓶中偏高;定容时俯视观察液面偏高.
(2)综合分析步骤①、②、③和④,这四步操作的最终目的为富集Br2.
(3)步骤⑤中,蒸馏用到的玻璃仪器除酒精灯、温度计、尾接管、锥形瓶外,还有冷凝管和蒸馏烧瓶;要达到提纯溴的目的,操作中应控制的关键条件为控制温度,并收集59.C时的馏分.
(4)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴.滴加稀硫酸之前,C中反应生成了NaBr、NaBrO3等,该反应的化学方程式为3Br2+3NaCO3=5NaBr+NaBrO3+3CO2↑.
分析 (1)依据溶液配制过程中浓硫酸稀释溶质物质的量不变计算需要的浓硫酸,未经冷却将溶液注入容量瓶中,热胀冷却,溶液体积小,浓度增大,定容时俯视观察液面,液面低于刻度线;
(2)步骤①制取溴,步骤②使溴挥发,步骤③吸收溴成溴离子,步骤④生成溴;
(3)根据蒸馏所需仪器回答;由于题干中给出信息Br2的沸点是59℃,提纯溴必须收集59℃时的馏分,所以控制温度得到馏分是关键;
(4)根据题给信息,溴和碳酸钠反应生成了溴化钠和溴酸钠,化合价升降总数相等和原子守恒配平方程式.
解答 解:(1)依据溶液配制过程中浓硫酸稀释溶质物质的量不变计算需要的浓硫酸,用物质的量浓度18.4mol/L的浓硫酸配制,若要配制500mL1mol/L的H2SO4溶液,需要浓硫酸溶液体积为V,则V×18.4mol/L=500mL×1mol/L,V=27.2ml,
未经冷却将溶液注入容量瓶中,热胀冷却,溶液体积小,浓度增大,结果偏高,定容时俯视观察液面,液面低于刻度线,配制溶液的浓度增大,配制结果偏高,
故答案为:27.2;偏高;偏高;
(2)步骤①制取溴,步骤②使溴挥发,步骤③吸收溴成溴离子,步骤④生成溴,故这四步操作的最终目的为富集溴,
故答案为:富集溴;
(3)蒸馏需要蒸馏烧瓶、冷凝管、酒精灯、温度计、牛角管和锥形瓶等;达到提纯溴的目的,操作中应控制的关键条件是把温度控制在溴的沸点59°C,并收集该温度下的馏分,
故答案为:冷凝管(或冷凝器);蒸馏烧瓶;控制温度计温度,并收集59℃时的馏分;
(4)根据题给信息,溴和碳酸钠反应生成了溴化钠和溴酸钠,据此写出反应方程式为:Br2+Na2CO3→NaBr+NaBrO3,根据化合价升降总数相等配平为:3Br2+3Na2CO3→5NaBr+NaBrO3,根据原子守恒,还有产物二氧化碳3mol,故反应方程式为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,
故答案为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑.
点评 本题结合海水提取溴的过程,考查了实验基本操作、实验方案的评价、氧化还原反应方程式的书写,难度中等,在配平时抓住化合价升降总数相等.

| A. | 所有烷烃分子中均含有碳碳单键 | |
| B. | 苯及其同系物、醇类和羧酸都能发生取代反应 | |
| C. | 大气臭氧层的破坏主要与氟氯烃的氟原子有关 | |
| D. | 氨基酸与酸、碱都能发生反应生成盐 |
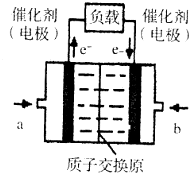 氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:
氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:2H2-4e-═4H+
O2+4e-+4H+═2H2O
下列说法不正确的是( )
| A. | 右电极为电池正极,b处通入的物质是氧气 | |
| B. | 左电极为电池负极,a处通入的物质是氧气 | |
| C. | H2在负极发生氧化反应 | |
| D. | 供电时的总反应为:2H2+O2=2H2O |
| A. | 溴乙烷、乙酸都能与NaOH水溶液反应 | |
| B. | 乙酸乙酯、乙酸钠都能与稀硫酸反应 | |
| C. | 福尔马林、葡萄糖与新制Cu(OH)2共热都有红色沉淀生成 | |
| D. | 乙烯、乙醛都能使溴水褪色 |
| A. | H2O | B. | N2 | C. | H2O2 | D. | C2H4 |
| A. | H2和NH3 | B. | H2,SO2和CO | C. | H2S和SO2 | D. | NH3,H2S和SO2 |
 某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等). 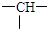 ,它可能的结构数目是( )
,它可能的结构数目是( )