题目内容
【题目】在Fe、Cu、稀H2SO4组成的原电池中。下列叙述错误的是
A.电子流从铁棒经导线流入铜棒B.溶液逐步变为浅绿色
C.溶液的酸性减弱D.气泡在铁片上产生
【答案】D
【解析】
A. Fe、Cu、稀H2SO4组成的原电池中,Fe作为负极,Cu为正极。电子由负极流向正极。A项正确;
B. Fe 作为负极发生氧化反应生成Fe2+, Fe2+水溶液呈浅绿色。B项正确;
C. Cu为正极发生还原反应,H+得电子生成氢气,溶液中氢离子减少酸性减弱。C项正确;
D. 有气泡是因为产生了氢气,是H+得电子在正极Cu上产生的。D项错误;
故答案选D

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是![]() ,并含少量的
,并含少量的![]() 、
、![]() 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
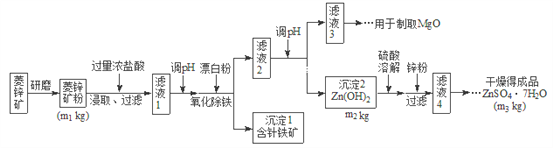
(1)将菱锌矿研磨成粉的目的是_______________。
(2)写出Fe3+水解的离子方程式_________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
开始溶解的pH |
|
|
|
|
Ksp |
|
|
|
|
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
![]() 大理石粉
大理石粉 ![]() 石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中![]() 的质量分数不低于__________用代数式表示
的质量分数不低于__________用代数式表示