题目内容
【题目】氯化亚铁常用于检测硒、污水处理等。制备FeCl2的方法有多种。
(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入_____________然后保存溶液。
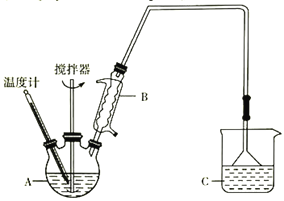
(2)用H2还原无水FeCl3制取FeCl2,装置如下:
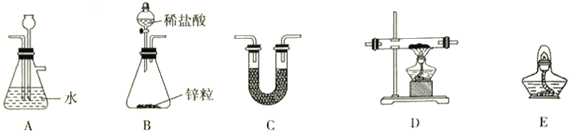
已知:FeCl2、FeCl3易吸水。
①H2还原无水FeCl3制取FeCl2的化学方程式为__________________________________。
②上述仪器的连接顺序为(可多次使用)______________,C中盛放的试剂是___________________。
(3)按下图装置,用162.5g无水氯化铁和225g氯苯,控制反应温度在一定范围加热3h。冷却,分离提纯得到粗产品。反应为2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
已知:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | _________ | _________ |
沸点/℃ | 132 | 173 | _________ | _________ |
①仪器A的名称是____________;下列装置可以代替装置C的是_____________(填字母)。

②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,氧化产物是_________________________。
③反应的温度最好控制在_______________左右。
④反应结束后,冷却实验装置,将仪器A 内物质经过过滤洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_________________________。
⑤通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过80%,则烧杯中试剂为加有酚酞且理论上至少含_______gNaOH的溶液。
【答案】 还原铁粉、稀盐酸 H2+2FeCl3=2FeCl2+2HCl BACDCE或BCDCE 碱石灰 三颈烧瓶 ab C6H4Cl2 132℃ 苯 16
【解析】(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入过量的铁粉,防止Fe2+被氧化,然后保存溶液。
(2)①H2还原无水FeCl3制取FeCl2的化学方程式为:H2+2FeCl3=2FeCl2+2HCl
因为FeCl2、FeCl3易吸水按如图中装置的特点,可以知道,用H2还原无水FeCl3制取无水FeCl2,B装置一般用锌和稀盐酸制备H2,A装置用来除去氢气中的氯化氢, C装置用来干燥氢气,可以装置碱石灰, D装置中用氢气与氯化氯生成氯化亚,E装置将多余的氢气除去。据此答题; BACDCE或BCDCE 碱石灰
(3)①仪器A的名称是三颈烧瓶;装置C是防倒吸装置,所以ab具有这样的功能,故答案:三颈烧瓶 ab 。
②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,根据化合价变化规律知氧化产物是C6H4Cl2。
③三颈瓶内物质为氯化亚铁、C6H5Cl、C6H5Cl,根据表格中沸点的高低可以控制反应在132℃,对滤液进行蒸馏可。因为产品为FeCl2不溶于C6H5Cl、C6H4Cl2、苯,所以可以选择苯作为洗涤所用的试剂。答案:132℃。苯。
2FeCl3 + C6H5Cl→2FeCl2+C6H4Cl2+HCl HCl+ NaOH=NaCl+H2O
2mol 1mol 1mol
n(FeCl3)=1mol n(C6H5Cl)=2mol, C6H5Cl过量,根据关系式2FeCl3![]() NaOH氯化铁转化率达到或超过80%,需要n(NaOH)=0.4mol. m(NaOH)=16g,,答案:16g.
NaOH氯化铁转化率达到或超过80%,需要n(NaOH)=0.4mol. m(NaOH)=16g,,答案:16g.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D