题目内容
【题目】按要求填空
(1)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(2)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(3)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该化合物加热至结晶水全部失去,剩余的残渣为b g,则n=________。
(4)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为____________。
(5)在某温度下,NaOH的溶解度为20g,该温度下将80gNaOH投入220g水中,充分搅拌后,静置,测得溶液的密度为1.2g/mL,则该溶液中溶质的物质的量浓度为____________。
【答案】17∶16 4∶3 (a-b)M/18b 5(a+b-d) g·mol-1 5.0 mol·L-1
【解析】
(1)将等物质的量的NH3和CH4混合,根据m=nM可知混合气体中NH3与CH4的质量比为摩尔质量之比,即为17:16。
(2)1分子氨气和甲烷含有的氢原子个数分别是3和4,因此要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为4:3。
(3)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该化合物加热至结晶水全部失去,剩余的残渣为b g,则![]() ,解得n=(a-b)M/18b。
,解得n=(a-b)M/18b。
(4)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则根据根据质量守恒定律可知C的质量是(a+b-d)g,所以C的摩尔质量为(a+b-d)g÷0.2mol=5(a+b-d)g·mol-1。
(5)在某温度下,NaOH的溶解度为20g,该温度下将80gNaOH投入220g水中,实际溶解的氢氧化钠质量是![]() ,充分搅拌后,静置,溶液的质量是264g,测得溶液的密度为1.2g/mL,溶液体积是
,充分搅拌后,静置,溶液的质量是264g,测得溶液的密度为1.2g/mL,溶液体积是![]() 220mL=0.22L,溶质的物质的量是44g÷40g/mol=1.1mol,则该溶液中溶质的物质的量浓度为1.1mol÷0.22L=5.0 mol·L-1。
220mL=0.22L,溶质的物质的量是44g÷40g/mol=1.1mol,则该溶液中溶质的物质的量浓度为1.1mol÷0.22L=5.0 mol·L-1。

【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是![]() ,并含少量的
,并含少量的![]() 、
、![]() 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
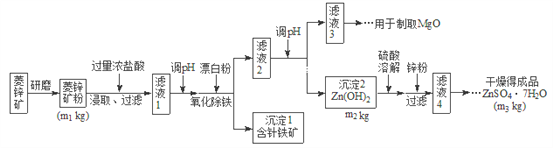
(1)将菱锌矿研磨成粉的目的是_______________。
(2)写出Fe3+水解的离子方程式_________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
开始溶解的pH |
|
|
|
|
Ksp |
|
|
|
|
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
![]() 大理石粉
大理石粉 ![]() 石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中![]() 的质量分数不低于__________用代数式表示
的质量分数不低于__________用代数式表示