题目内容
8.25℃时,0.1mol•L-1氨水中c(H+)/c(OH-)=1×10-8,下列叙述正确的是( )| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7 的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 浓度均为0.1 mol•L-1的NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1的 H2SO4溶液等体积混合后所得溶液中:2c(NH4+)+2c(NH3•H2O)=c(SO42-) |
分析 A、25℃时Kw=1×10-14,0.1mol•L-1氨水中c(H+)/c(OH-)=1×10-8,则c(H+)=1×10-11mol/L,c(OH-)=1×10-3mol/L;
B、据电荷守恒分析;
C、一水合氨电离使溶液显碱性,铵根离子水解使溶液显酸性,浓度均为0.1 mol•L-1的NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中,一水合氨的电离程度大于铵根离子的水解程度;
D、0.1 mol•L-1的氨水与0.05 mol•L-1的 H2SO4溶液等体积混合后恰好反应生成(NH4)2SO4,据物料守恒分析.
解答 解:A、25℃时Kw=1×10-14,0.1mol•L-1氨水中c(H+)/c(OH-)=1×10-8,则c(H+)=1×10-11mol/L,故A正确;
B、pH=7 的NH4Cl和NH3•H2O的混合溶液:c(Cl-)=c(NH4+)>c(H+)=c(OH-),故B错误;
C、浓度均为0.1 mol•L-1的NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中,一水合氨的电离程度大于铵根离子的水解程度,所以c(NH4+)>c(Cl-),c(OH-)>c(H+),NH3•H2O是弱碱,电离程度很小,所以其浓度关系为c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+),故C正确;
D、(NH4)2SO4溶液中据物料守恒有c(NH4+)+c(NH3•H2O)=2c(SO42-),故D错误;
故选AC.
点评 本题考查了水的离子积常数的应用、溶液中的电荷守恒、物料守恒和离子浓度大小比较,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.用NA表示阿伏加德罗常数的值,下列叙述正确的是(Cu-64 O-16)( )
| A. | 1molNa2O2晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数为0.1NA | |
| C. | 32gO2和32g O3的所含的氧原子数都是为2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |
3.25℃时,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Na+、NH4+、SO42-、ClO- | |
| B. | KW/c(H+)=0.1 mol•L-1的溶液中:Na+、K+、MnO4-、HCO3- | |
| C. | 0.1 mol•L-1的Na2SO3溶液中:K+、H+、SO42-、NO3- | |
| D. | 澄清透明的溶液中:Fe3+、Na+、Cl-、SO42- |
13.将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
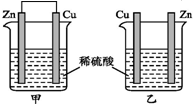

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的酸性均减弱 | D. | 产生气泡的速率甲比乙慢 |
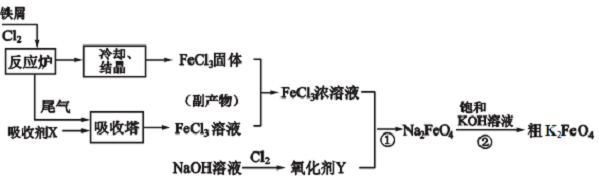
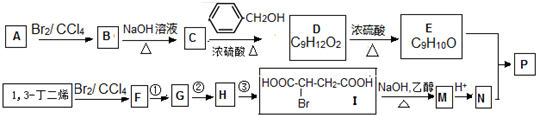
 ,
,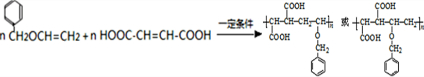 高聚物P的亲水性比由E形成的聚合物强(填“强、弱”).
高聚物P的亲水性比由E形成的聚合物强(填“强、弱”).
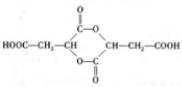 ;
;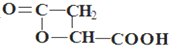 .
.