题目内容
20.有一瓶铁粉,因保存不好,其中有部分铁被氧化成Fe2O3.今取该铁粉0.766g进行试验,将其溶于过量盐酸,向所得溶液中加入KSCN溶液,溶液未出现红色,再用水稀释至100mL,取出10mL通入氯气14.6mL(标况),恰好使溶液中无Fe2+,求该铁粉中铁的百分含量.分析 首先,向所得溶液中加入KSCN溶液,溶液未出现红色,说明里面没有3价铁离子,因为是过量的盐酸,所以里面都是亚铁离子了(不可能有单价铁).再用水稀释至100mL,取出10mL,所以氯气氧化的是全部的亚铁离子的十分之一.题目的思路是先用氯气和亚铁反应来算出铁离子的量,转化成铁原子的质量(注意先算出来的是十分之一),算出混合物中氧的质量并转化成氧的物质的量,再算出氧化铁的质量,最后很容易算出铁粉中铁的百分含量,由此分析解答.
解答 解:铁粉投入盐酸后,盐酸先与氧化铁反应,接着生成的铁离子与单质铁反应生成亚铁离子,最后单质铁与稀盐酸反应生成亚铁离子,
Cl2 +2Fe2+=2Fe3++2Cl-
$\frac{14.6mL}{22400mL}$ 0.0013mol
根据元素守恒,所以原铁元素物质的量为0.013mol,设氧化铁为xmol,铁为ymol,则$\left\{\begin{array}{l}{2x+y=0.013}\\{160x+56y=0.766}\end{array}\right.$
解得y=0.0114所以铁的质量为56×0.0114=0.639g,所以铁粉中铁的百分含量为:$\frac{0.639g}{0.766g}×100%$=83.5%,答:该铁粉中铁的百分含量为:83.5%.
点评 本题考查了有关铁元素的计算,题目难度中等,采用原子守恒可简化计算,但解题时要注意氯气氧化的是全部的亚铁离子的十分之一.

练习册系列答案
相关题目
10.(多项选择题)下列说法中正确的是( )
| A. | SO3、NO3-、BF3都是平面三角型 | B. | P4、CS2、PH3都是非极性分子 | ||
| C. | 金刚石、石墨、SiC都是原子晶体 | D. | 第一电离能:N>O>C |
11.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| B. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 | |
| C. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 |
8.25℃时,0.1mol•L-1氨水中c(H+)/c(OH-)=1×10-8,下列叙述正确的是( )
| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7 的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 浓度均为0.1 mol•L-1的NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1的 H2SO4溶液等体积混合后所得溶液中:2c(NH4+)+2c(NH3•H2O)=c(SO42-) |
15.下列物质属于油脂的是( )
| A. | 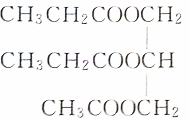 | B. | 润滑油 | ||
| C. | 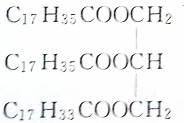 | D. | 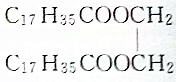 |
5.某溶液X可能含有K+、Fe2+、Fe3+、CO32-、NO3-、SO42-中的一种或几种,现每次取该溶液100mL分别进行如下实验,下列判断不正确的是( )


| A. | 溶液中一定不存在CO32- | B. | 溶液中一定不存在Fe3+ | ||
| C. | 溶液中一定存在K+ | D. | 溶液中c(NO3-)=0.1mol/L |
7.已知四种元素的原子半径如表所示:
根据表中数据推测磷元素的原子半径可能是( )
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10m | B. | 1.20×10-10m | C. | 1.10×10-10m | D. | 0.70×10-10m |
4.下列化学方程式不正确的是( )
| A. | 乙醇与浓氢溴酸反应:CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热:CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr | |
| C. | 苯酚钠中通入二氧化碳:2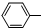 ONa+CO2+H2O→2 ONa+CO2+H2O→2 OH+Na2CO3 OH+Na2CO3 | |
| D. | 淀粉在稀硫酸作用下水解:(C6H10O5)n(淀粉)+nH2O$→_{△}^{稀硫酸}$nC6H12O6 |
5.日本福岛第一核电站泄漏出微量的钚(Pu),下列关${\;}_{94}^{239}$Pu叙述正确的是( )
| A. | 质子数是94 | B. | 原子序数是239 | C. | 质量数是94 | D. | 中子数是239 |