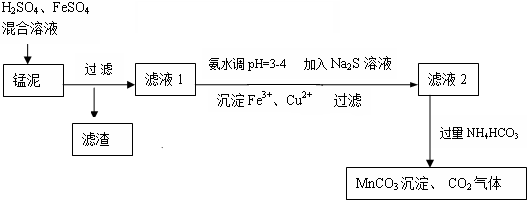
��Ŀ����
12��A��B��C��D��E��ԭ��������С�������е����ֶ�����Ԫ�أ�����A��B��C��D��ԭ������֮��Ϊ32��A��Ԫ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�B��C�������ڣ�C��Dλ��ͬ���壮��1��д��һ����֤��D��E��Ԫ�طǽ�����ǿ����ʵ�Ļ�ѧ����ʽCl2+H2S=2HCl+S����
��2��A��C��ɵĻ������к��еĻ�ѧ������Ϊֻ�й��ۼ����ֻ�й��ۼ�����ֻ�����Ӽ����������Ӽ����й��ۼ�����
��3��A��B��C��D����Ԫ���е����������һ��ǿ�ᣬ��ǿ���ϡ��Һ����ͭ��Ӧ���������������õ���ռ�����������ʵ����İٷֱ���25%��
��4����A��B��C��D����Ԫ����ɵ�һ�����ӻ�����X��
����֪1molX��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���壮д������������X��NaOHŨ��Һ��Ӧ�����ӷ���ʽNH4++OH-$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O��
����֪X���������ᷴӦ����������ˮ��Ӧ��д��X�Ļ�ѧʽ��NH4��2SO3��
���� A��B��C��D��E��ԭ��������С�������е����ֶ�����Ԫ�أ�����A��B��C��D��ԭ������֮��Ϊ32��A��Ԫ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ���AΪHԪ�أ�B��C�������ڣ�C��Dλ��ͬ���壬��B��ԭ������Ϊx����Cԭ������Ϊx+1��Dԭ������Ϊx+1+8����1+x+x+1+x+1+8=32�����x=7����BΪNԪ�أ�CΪOԪ�أ�DΪSԪ�أ���EΪCl��
��1������Ԫ�ص���֮����ת������֤���ǽ�����ǿ����
��2��A��C��ɵĻ�����ΪH2O��H2O2��
��3����H��N��O��S����Ԫ���е�������ɵ�һ��ǿ�ᣬ��ǿ���ϡ��Һ����ͭ��Ӧ�������Ϊ���ᣬϡ������Cu��Ӧ����ʽΪ��3Cu+8HNO3��ϡ��=3Cu��NO3��2+2NO��+4H2O��
��4����H��N��O��S����Ԫ����ɵ�һ�����ӻ�����X��
��1molX��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���壬˵��������������ΪNH4+����1molA�к���2molNH4+����AΪ����炙�������泥�笠����������������ӷ�Ӧ���ɰ�����
��X���������ᷴӦ����������ˮ��Ӧ����AΪ������泥�
��� �⣺A��B��C��D��E��ԭ��������С�������е����ֶ�����Ԫ�أ�����A��B��C��D��ԭ������֮��Ϊ32��A��Ԫ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ���AΪHԪ�أ�B��C�������ڣ�C��Dλ��ͬ���壬��B��ԭ������Ϊx����Cԭ������Ϊx+1��Dԭ������Ϊx+1+8����1+x+x+1+x+1+8=32�����x=7����BΪNԪ�أ�CΪOԪ�أ�DΪSԪ�أ���EΪCl��
��1������Ԫ�ص���֮����ת������֤���ǽ�����ǿ������Ӧ����ʽΪ��Cl2+H2S=2HCl+S����
�ʴ�Ϊ��Cl2+H2S=2HCl+S����
��2��A��C��ɵĻ�����ΪH2O��H2O2����ֻ�й��ۼ���
�ʴ�Ϊ��ֻ�й��ۼ���
��3����H��N��O��S����Ԫ���е�������ɵ�һ��ǿ�ᣬ��ǿ���ϡ��Һ����ͭ��Ӧ�������Ϊ���ᣬϡ������Cu��Ӧ����ʽΪ��3Cu+8HNO3��ϡ��=3Cu��NO3��2+2NO��+4H2O���������������õ���ռ�����������ʵ����İٷֱ���$\frac{2}{8}$��100%=25%��
�ʴ�Ϊ��25%��
��4����H��N��O��S����Ԫ����ɵ�һ�����ӻ�����X��
��1molX��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���壬˵��������������ΪNH4+����1molA�к���2molNH4+����AΪ����炙�������泥�笠����������������ӷ�Ӧ���ɰ�������Ӧ���ӷ���ʽΪ��NH4++OH-$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O��
�ʴ�Ϊ��NH4++OH-$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O��
��X���������ᷴӦ����������ˮ��Ӧ����AΪ������泥���ѧʽΪ��NH4��2SO3���ʴ�Ϊ����NH4��2SO3��
���� ���⿼��λ�ýṹ���ʵ�Ӧ�á������ƶϵȣ���ȷY��Z��W��λ�ü�ԭ�������Ĺ�ϵ���ƶ�Ԫ���ǹؼ�����Ҫѧ����������Ԫ�ػ��������ʣ��Ѷ��еȣ�

 �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д� ��������ϵ�д�
��������ϵ�д�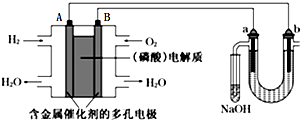
| A�� | ��ع���ʱ��B����ӦʽΪO2+2H2O+4e-=4OH- | |
| B�� | ���ʱ����������·���ǣ�A�������·��b������Һ��a����B�� | |
| C�� | NaOH��Һ������պ�������Һ������Ư��ˮ | |
| D�� | �����������2.24L����״����H2ʱ��a����ΧҲ�����2.24L����״�������� |
| A�� | ����Һ�������ӵ�Ũ�ȣ�c��H+��=1��10-11 mol•L-1 | |
| B�� | pH=7 ��NH4Cl��NH3•H2O�Ļ����Һ��c��Cl-����c��NH4+����c��H+��=c��OH-�� | |
| C�� | Ũ�Ⱦ�Ϊ0.1 mol•L-1��NH3•H2O��NH4Cl��Һ�������Ϻ�ļ�����Һ�У�c��NH4+����c��Cl-����c��NH3•H2O����c��OH-����c��H+�� | |
| D�� | 0.1 mol•L-1�İ�ˮ��0.05 mol•L-1�� H2SO4��Һ�������Ϻ�������Һ�У�2c��NH4+��+2c��NH3•H2O��=c��SO42-�� |

| A�� | ��Һ��һ��������CO32- | B�� | ��Һ��һ��������Fe3+ | ||
| C�� | ��Һ��һ������K+ | D�� | ��Һ��c��NO3-��=0.1mol/L |
| Ԫ�� | N | S | O | Si |
| ԭ�Ӱ뾶/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A�� | 0.80��10-10m | B�� | 1.20��10-10m | C�� | 1.10��10-10m | D�� | 0.70��10-10m |
| A�� | ����һ��������������������Ӧˮ������������� | |
| B�� | ����һ����ɫ���壬������̬�⻯��ܲ��ȶ�������������ɫ������ϡHNO3�ij��� | |
| C�� | ������������ˮ��ϡHNO3������������Ϊǿ�� | |
| D�� | ����������ɫ��ζ���壬û��H2S�ȶ� |
| A�� | �Ҵ���Ũ�����ᷴӦ��CH3CH2OH+HBr$\stackrel{��}{��}$CH3CH2Br+H2O | |
| B�� | ������������������Һ���ȣ�CH3CH2Br+NaOH$��_{��}^{ˮ}$CH3CH2OH+NaBr | |
| C�� | ��������ͨ�������̼��2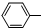 ONa+CO2+H2O��2 ONa+CO2+H2O��2 OH+Na2CO3 OH+Na2CO3 | |
| D�� | ������ϡ����������ˮ�⣺��C6H10O5��n�����ۣ�+nH2O$��_{��}^{ϡ����}$nC6H12O6 |