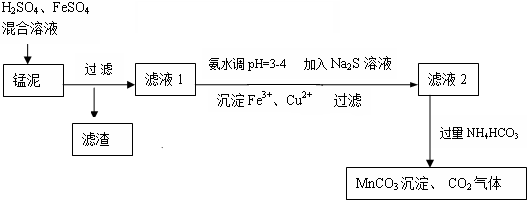
题目内容
13.将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )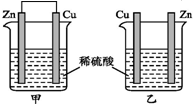
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的酸性均减弱 | D. | 产生气泡的速率甲比乙慢 |
分析 由图可知,甲构成原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子生成H2,电池总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
解答 解:A.甲是原电池,正极铜片上发生还原反应 2H++2e-=H2↑,乙装置中在锌片上发生反应 Zn+2H+=Zn2++H2↑,铜片上无气体产生,故A错误;
B.甲装置是原电池,铜片做正极,乙不是原电池,故B错误;
C.两烧杯中的氢离子均发生反应,溶液中氢离子浓度减少,溶液的酸性均减弱,故C正确;
D.甲中构成原电池,加快反应速率,所以产生气泡的速度甲比乙快,故D错误;
故选:C.
点评 本题考查原电池的有关知识,难度不大,注意把握原电池的构成条件及工作原理,有利于基础知识的巩固.

练习册系列答案
相关题目
8.25℃时,0.1mol•L-1氨水中c(H+)/c(OH-)=1×10-8,下列叙述正确的是( )
| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7 的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 浓度均为0.1 mol•L-1的NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1的 H2SO4溶液等体积混合后所得溶液中:2c(NH4+)+2c(NH3•H2O)=c(SO42-) |
4.下列化学方程式不正确的是( )
| A. | 乙醇与浓氢溴酸反应:CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热:CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr | |
| C. | 苯酚钠中通入二氧化碳:2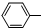 ONa+CO2+H2O→2 ONa+CO2+H2O→2 OH+Na2CO3 OH+Na2CO3 | |
| D. | 淀粉在稀硫酸作用下水解:(C6H10O5)n(淀粉)+nH2O$→_{△}^{稀硫酸}$nC6H12O6 |
8.下列互为同素异形体的是( )
| A. | T与D | B. | 40K与40Ca | C. | 金刚石与石墨 | D. | 正丁烷与异丁烷 |
18.将0.2mol两种气态烃组成的混合气体完全燃烧后得到(标准状况下)6.72L二氧化碳和7.2g水,下列说法正确的是( )
| A. | 一定有乙烯 | B. | 可能有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
5.日本福岛第一核电站泄漏出微量的钚(Pu),下列关${\;}_{94}^{239}$Pu叙述正确的是( )
| A. | 质子数是94 | B. | 原子序数是239 | C. | 质量数是94 | D. | 中子数是239 |
2.有机物A和B只由C、H、O中的2种或3种元素组成,等物质的量的A与B分别完全燃烧时,消耗氧气的物质的量相等,则A与B相对分子质量之差(其中n为正数)不可能为( )
| A. | 8n | B. | 18n | C. | 14n | D. | 44n |
3.乙醇分子中不同的化学键如图.下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )


| A. | 与金属钠反应时,只有键①断裂 | B. | 在Ag催化下与O2反应时,键①、③断裂 | ||
| C. | 与CuO反应时,只有键①断裂 | D. | 与浓硫酸共热至170℃时,键②、⑤断裂 |