题目内容
1.下列反应不能发生的是( )| A. | KHCO3+HCl═KCl+CO2↑+H2O | B. | AgNO3+NaCl═AgCl↓+NaNO3 | ||
| C. | NaCO3+Ca(OH)2═CaCO3↓+2NaOH | D. | 2HCl+NaSO4═2NaCl+H2SO4 |
分析 根据复分解反应的条件即有气体或者沉淀或者有弱电解质生成判断.
解答 解:因为复分解反应发生的条件即有气体或者沉淀或者有弱电解质生成,而A有气体生成,B、C有沉淀生成,D既没有气体、沉淀又没有弱电解质生成,所以不能发生,故选:D.
点评 本题着重考查复分解反应发生的条件的准确理解,并会灵活分析进行解答.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
12.下列由相关实验现象所推出的结论正确的是( )
| A. | 铁在常温下不溶于浓硝酸,说明铁与浓硝酸不反应 | |
| B. | 将氯气溶于水后溶液呈浅黄绿色,说明氯气与水没有完全反应 | |
| C. | 将某气体通入品红溶液中溶液褪色,说明该气体一定是二氧化硫 | |
| D. | 向溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- |
16.下列四幅图中,与胶体性质有关的是( )


| A. | ①④ | B. | ②③ | C. | ①②③ | D. | 全部 |
20.由实验现象推出的结论正确的是( )
| 选项 | 实验方案 | 现象 | 结论 |
| A | 将水垢置于盛食醋的试管中 | 有气泡产生 | 醋酸的酸性比碳酸强 |
| B | 用湿润的蓝色试纸检验某气体 | 试纸变红 | 气体是酸性氧化物 |
| C | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | NaHCO3不溶于水 |
| D | 向酚酞溶液中加少量Na2O2 | 溶液变红 | Na2O2是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
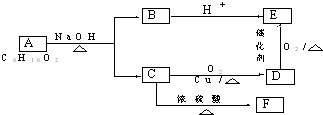
 .
.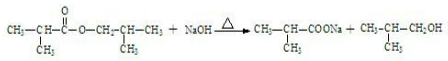 .
.