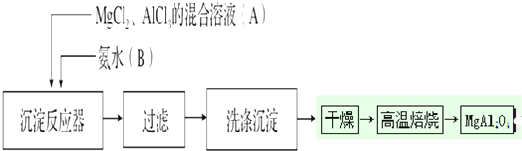
题目内容
2.寻找清洁能源一直是化学家努力的方向,下列关于能源的说法错误的是( )| A. | 氢气热值高,其燃烧产物是水,是一种理想的清洁燃料 | |
| B. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源,保护环境 | |
| C. | 煤的气化技术在一定程度上实现了煤的高效、清洁利用 | |
| D. | 石油作为重要的可再生能源应该被尽量地利用 |
分析 A.氢气的燃烧产物是水,属于清洁能源;
B.太阳能无污染,属于清洁能源;
C.煤的气化是把煤炼成焦炭,再将焦炭在高温下与水蒸气反应,得到CO和H2;
D.石油是不可再生能源.
解答 解:A.氢气的燃烧产物是水,无污染,属于清洁能源,故A正确;
B.太阳能无污染,属于清洁能源,利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境,故B正确;
C.煤的气化是把煤炼成焦炭,再将焦炭在高温下与水蒸气反应,得到CO和H2;可以减少二氧化硫等有毒气体的排放,实现了煤的高效、清洁利用,故C正确
D.石油是化石能源属于不可再生能源,故D错误;
故选D.
点评 本题考查了能源,注意对常见能源的归纳和整理,题目难度不大.

练习册系列答案
相关题目
12.下列有关实验叙述错误的是( )
| A. | 实验室可用硫酸铜溶液除去乙炔中的H2S等杂质气体 | |
| B. | 苯和溴水在溴化铁溶液催化作用下发生取代反应生成溴苯 | |
| C. | 只用溴水就可以将苯、四氯化碳、酒精、氢氧化钠溶液这四种物质区别开 | |
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
13.玻璃器皿上沾有一些用水洗不掉的残留物,其洗涤方法正确的是( )
①用酒精洗涤试管内壁上残留的碘②用酒精洗涤试剂瓶中残留的苯酚③用稀氨水洗涤试管壁上银镜④用热碱液洗涤试管内壁上的油脂.
①用酒精洗涤试管内壁上残留的碘②用酒精洗涤试剂瓶中残留的苯酚③用稀氨水洗涤试管壁上银镜④用热碱液洗涤试管内壁上的油脂.
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
10.下列物质中,在常温常压时呈气态的是( )
| A. | 乙醇 | B. | 苯 | C. | 甲醛 | D. | 四氯化碳 |
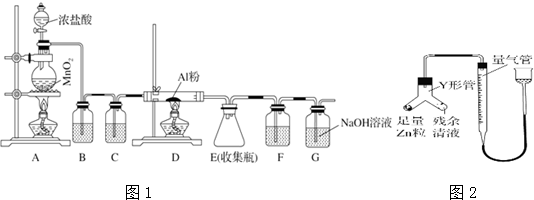
11.资料显示:
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究,实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是控制分液漏斗的活塞,使浓硫酸缓慢滴入A中.
(4)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是A中反应一会生成二氧化硫,C中才能反应.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(5)完成对所得产品的检测的实验:
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究,实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是控制分液漏斗的活塞,使浓硫酸缓慢滴入A中.
(4)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是A中反应一会生成二氧化硫,C中才能反应.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(5)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0mol•L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2S、Na2CO3, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I- 产品纯度:$\frac{9}{w}$×100%. |
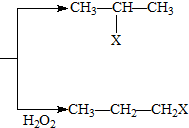 (X为卤素原子)
(X为卤素原子)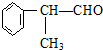 的物质,该物质是一种香料.
的物质,该物质是一种香料.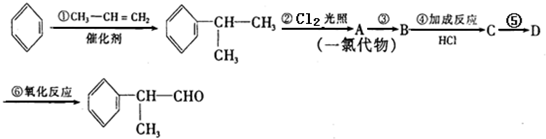
 .
.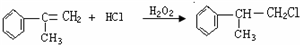 .
.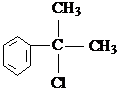 的水解产物
的水解产物 不能经氧化反应⑥而得到产品.
不能经氧化反应⑥而得到产品.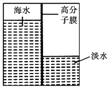 海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr.
+2NaBr.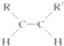 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式:
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式: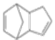 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$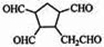 .
. ).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):
).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):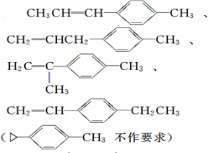 .
.