题目内容
7. 海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.(1)海水中溴元素以Br-的形式存在,工业上用空气吹出法从海水中提取溴,写出该反应的离子方程式:2Br-+Cl2═Br2+2Cl-.
(2)请写出电解饱和食盐水制取氯气的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.若电解2L饱和食盐水时,通过电路的电子的物质的量为2mol,则溶液混合均匀后的pH为14;若用该溶液将阳极产物全部吸收,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,所得溶液的pH>7(填“>”、“=”或“<”),理由是ClO-+H2O?HClO+OH-.
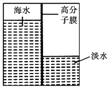
(3)海水淡化是国际上研究的热点问题,我国科学家在利用高分子膜进行海水淡化的研究上取得了一些成绩.如图,左侧为海水,右侧为经过一段时间后由左侧高分子膜渗透得到的淡水,该变化是物理(填“物理”或“化学”)变化.
(4)轮船浸没在海水中的部分容易发生锈蚀,其负极反应式为Fe-2e-═Fe2+.
分析 (1)氯气和溴离子反应生成溴单质;
(2)电解饱和食盐水得到的是氢氧化钠、氢气和氯气,2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,方程式中转移2mol电子,阳极产物为氯气,氯气能与氢氧化钠反应;
(3)有新物质生成的是化学变化;
(4)钢铁中的铁和碳在潮湿的空气中构成许多微小的原电池,能发生电化学腐蚀,铁做负极失电子形成阳离子被腐蚀.
解答 解:(1)氯气和溴离子反应生成溴单质,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,故答案为:2Br-+Cl2═Br2+2Cl-;
(2)电解饱和食盐水得到的是氢氧化钠、氢气和氯气,即2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,方程式中转移2mol电子,通过电路的电子的物质的量为2mol时,生成2mol氢氧化钠,氢氧根的浓度为1mol/L,pH为14,阳极产物为氯气,物质的量为1mol,氯气能与氢氧化钠反应,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,恰好完全反应,次氯酸钠水解显碱性,pH>7,ClO-+H2O?HClO+OH-,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;14;Cl2+2OH-═Cl-+ClO-+H2O;>;ClO-+H2O?HClO+OH-;
(3)该过程没有新物质生成,是物理变化,故答案为:物理;
(4)中性或弱酸性条件下,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,钢铁在潮湿的空气中发生吸氧腐蚀,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上得电子发生还原反应;
故答案为:Fe-2e-═Fe2+.
点评 本题考查了海水资源的利用分析判断,主要是电解原理的理解应用,掌握基础是关键,题目难度中等.

| A. | C2H2 | B. | C2H4 | C. | C2H6 | D. | C3H6 |
| A. | 氢气热值高,其燃烧产物是水,是一种理想的清洁燃料 | |
| B. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源,保护环境 | |
| C. | 煤的气化技术在一定程度上实现了煤的高效、清洁利用 | |
| D. | 石油作为重要的可再生能源应该被尽量地利用 |
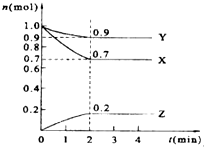 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. ;
;


