题目内容
20.下列各种叙述中,正确的是( )①Cl-和Cl2的性质相同 ②ClO-具有氧化性 ③Cl-比Cl多一个电子 ④盐酸兼有酸性、氧化性、还原性 ⑤Cl-具有酸性 ⑥Cl2的氧化性比MnO2的强 ⑦Cl2只有氧化性而没有还原性.
| A. | ①②⑤⑥ | B. | 仅②④⑥ | C. | 仅②③④ | D. | ②③④⑥ |
分析 ①氯离子和氯气结构不同性质不同;
②次氯酸根离子中氯元素化合价为+1价,化合价可以降低,ClO-具有氧化性;
③氯原子得到一个电子形成氯离子;
④盐酸中的HCl,氢元素+1价具有氧化性和酸性,Cl-离子在最低价具有还原性;
⑤Cl-无酸性;
⑥Cl2的氧化性比MnO2的弱;
⑦氯气中氯元素化合价0价变化为-1价和+1价.
解答 解:①氯离子和氯气分子中的原子结构不同,性质不同,故①错误;
②次氯酸根离子中氯元素化合价为+1价,化合价可以降低,在溶液中表现强氧化性,ClO-具有氧化性,故②正确;
③氯原子得到一个电子形成氯离子,Cl-比Cl多一个电子,故③正确;
④盐酸中的HCl,氢元素+1价具有氧化性和酸性,Cl-离子在最低价具有还原性,盐酸兼有酸性、氧化性、还原性,故④正确;
⑤溶液中显酸性的是氢离子,Cl-无酸性,故⑤错误;
⑥二氧化锰和浓盐酸加热反应生成氯气,氧化剂氧化性大于氧化产物,Cl2的氧化性比MnO2的弱,不同条件氧化性强弱不同,故⑥错误;
⑦氯气中氯元素化合价0价变化为-1价和+1价,Cl2即有氧化性也有还原性,故⑦错误;
故选C.
点评 本题考查了氯及其化合物性质分析判断,主要是元素化合价变化判断氧化性和还原性的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列有关化学研究的正确说法是( )
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 只含一种元素的物质,一定不是化合物,但是可能是混合物 | |
| C. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| D. | 依据CO2、SO3、SiO2为酸性氧化物,可以得出结论:酸性氧化物均为非金属氧化物 |
11.下列粒子中,既具有氧化性,又具有还原性的是( )
| A. | Mg | B. | Zn2+ | C. | Fe2+ | D. | H2 |
15.把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
| A. | 稀HNO3 | B. | CuSO4溶液 | C. | FeCl3溶液 | D. | AgNO3溶液 |
5.我们做了一系列关于Na2CO3和NaHCO3性质实验,根据你的实验观察和记录,下面关于Na2CO3和NaHCO3性质的结论,正确的是( )
| A. | 受热时Na2CO3比NaHCO3稳定 | |
| B. | 同温同压下,在水中Na2CO3比NaHCO3溶解性小 | |
| C. | Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠反应 | |
| D. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3放出的CO2多 |
12.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素为类铅元素.下面有关它的原子结构和性质预测正确的是( )
| A. | 类铅元素原子的最外层电子数为7 | B. | 其常见价态为+2、+4、+6 | ||
| C. | 它的金属性比铅强 | D. | 它的原子半径比铅小 |
9. 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g)$\stackrel{一定条件}{→}$CO(g)+3H2(g) I.
CH4的转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min)
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH30H(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD (填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了右边的实验设计表中.
a.右表中剩余的实验条件数据:
n=150,m=$\frac{1}{3}$.
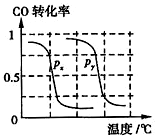
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=0.1 MPa.
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g)$\stackrel{一定条件}{→}$CO(g)+3H2(g) I.
CH4的转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min)
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH30H(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD (填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了右边的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
n=150,m=$\frac{1}{3}$.
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=0.1 MPa.
10.用核磁共振仪对分子式为C3H8O的有机物进行分析,核磁共振氢谱有三个峰,峰面积之比是1:1:6,则该化合物的结构简式为( )
| A. | CH3-O-CH2-CH3 | B. | 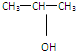 | C. | CH3CH2CH2OH | D. | C3H7OH |