题目内容
10.下列有关化学研究的正确说法是( )| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 只含一种元素的物质,一定不是化合物,但是可能是混合物 | |
| C. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| D. | 依据CO2、SO3、SiO2为酸性氧化物,可以得出结论:酸性氧化物均为非金属氧化物 |
分析 A.利用控制变量法研究反应速率,一般只有一个变量;
B.同种元素可以形成不同种单质;
C.丁达尔现象为胶体特有性质,不能区分三种分散系;
D.大多数的酸性氧化物是非金属氧化物.
解答 解:A.利用控制变量法研究反应速率,一般只有一个变量,则不能同时改变两个变量来研究反应速率的变化,故A错误;
B.化合物是由两种或两种以上元素形成的纯净物,只有一种元素可以形成不同种单质,比如氧气和臭氧,属于混合物,故B正确;
C.丁达尔现象为胶体特有性质,不能区分三种分散系,应利用分散系中分散质的直径大小将分散系分为溶液、胶体与浊液,故C错误;
D.大多数的酸性氧化物是非金属氧化物,但是Mn2O7属于酸性氧化物却是一种金属氧化物,故D错误,
故选B.
点评 本题考查较综合,涉及反应速率的影响因素、混合物的概念、分散系的分类及酸性氧化物的概念等,注重高考高频考点的考查,有利于基础知识的夯实,题目难度不大.

练习册系列答案
相关题目
3.在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,一明反应A(s)+2B(g)?C(g)+D(g)已达到平衡状态.①各气体物质的量浓度;②气体的总物质的量;③混合气体的平均摩尔质量;④混合气体的密度( )
| A. | 只有①② | B. | 只有①④ | C. | 只有①③④ | D. | ①②③④ |
5.过氧化钙难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等.
Ⅰ.某小组用含有少量氧化亚铁和氧化铁杂质的大理石制取过氧化钙的流程如下:
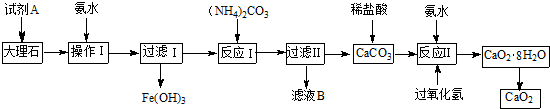
请回答下列问题:
(1)操作I的目的是调节溶液的pH,使铁元素完全沉淀,则试剂A最好选用c.
a.盐酸 b.硝酸 c.盐酸和过氧化氢 d.硫酸
(2)检验操作I中铁元素已沉淀完全的操作是取上层清液少许于试管中,滴加KSCN溶液,若溶液不变红,则铁元素已除净.
(3)滤液B主要成分的化学式是NH4Cl.
(4)反应Ⅱ是放热反应.保持H2O2物质的量一定,当H2O2浓度小于20%时,CaO2的产率随H2O2浓度的增大而增大;但浓度大于20%后,CaO2产率反而下降.试分析CaO2产率下降的可能原因是H2O2浓度高,反应速率快,反应放热使体系升温迅速,促使H2O2分解.
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量:
步骤1:准确称取0.3900g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入10mL蒸馏水和20mL磷酸(1:3),振荡使样品完全溶解;
步骤3:用0.1000mol•L-1 KMnO4标准溶液滴定至终点,记录数据;
步骤4:平行测定4次(数据记录见下表),计算试样中CaO2的质量分数.
已知:上述实验过程中反应关系为:CaO2~H2O2,5H2O2~2KMnO4
请回答下列问题:
(5)步骤3判断滴定达到终点的现象是当看到加入1滴KMnO4溶液,锥形瓶中溶液由无色变为浅红色(或粉红色、红色),30s不褪色,即达到滴定终点;
(6)由表中数据可知,该样品中CaO2含量为90%.若实验时刚洗净的滴定管未用KMnO4标准溶液润洗,则CaO2的质量分数测定结果偏高(填“偏高”、“偏低”或“无影响”).
Ⅰ.某小组用含有少量氧化亚铁和氧化铁杂质的大理石制取过氧化钙的流程如下:

请回答下列问题:
(1)操作I的目的是调节溶液的pH,使铁元素完全沉淀,则试剂A最好选用c.
a.盐酸 b.硝酸 c.盐酸和过氧化氢 d.硫酸
(2)检验操作I中铁元素已沉淀完全的操作是取上层清液少许于试管中,滴加KSCN溶液,若溶液不变红,则铁元素已除净.
(3)滤液B主要成分的化学式是NH4Cl.
(4)反应Ⅱ是放热反应.保持H2O2物质的量一定,当H2O2浓度小于20%时,CaO2的产率随H2O2浓度的增大而增大;但浓度大于20%后,CaO2产率反而下降.试分析CaO2产率下降的可能原因是H2O2浓度高,反应速率快,反应放热使体系升温迅速,促使H2O2分解.
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量:
步骤1:准确称取0.3900g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入10mL蒸馏水和20mL磷酸(1:3),振荡使样品完全溶解;
步骤3:用0.1000mol•L-1 KMnO4标准溶液滴定至终点,记录数据;
步骤4:平行测定4次(数据记录见下表),计算试样中CaO2的质量分数.
| 实验 | 1 | 2 | 3 | 4 |
| V(KMnO4)/mL | 19.50 | 21.50 | 19.48 | 19.52 |
请回答下列问题:
(5)步骤3判断滴定达到终点的现象是当看到加入1滴KMnO4溶液,锥形瓶中溶液由无色变为浅红色(或粉红色、红色),30s不褪色,即达到滴定终点;
(6)由表中数据可知,该样品中CaO2含量为90%.若实验时刚洗净的滴定管未用KMnO4标准溶液润洗,则CaO2的质量分数测定结果偏高(填“偏高”、“偏低”或“无影响”).
15.对于某些离子的检验方法(包括操作、现象、结论),完全正确的是( )
| A. | 向待测溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- | |
| B. | 向待测溶液中逐滴加入氢氧化钠溶液,开始有白色沉淀生成,继续滴加氢氧化钠溶液到过量,沉淀逐渐溶解,一定有Al3+ | |
| C. | 向待测溶液中先滴加盐酸酸化未出现沉淀,再加入BaCl2 溶液有白色沉淀产生,一定有SO42- | |
| D. | 向待测溶液中滴加NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,一定有NH4+ |
2.X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
(1)W在元素周期表的位置是第三周期第ⅣA族;W的原子半径比X的大(填“大”或“小”).
(2)X、Y、W气态氢化物的稳定性大小顺序H2O>CH4>SiH4(用化学式表示).
(3)写出Y单质的电子式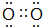 .
.
(4)振荡下,向Z单质与盐酸反应后的无色溶液中逐滴滴加NaOH溶液直至过量,能观察到的现象是先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;W的单质与氢氟酸反应的化学方程式是Si+4HF=SiF4↑+2H2↑.
(5)在25℃、101kPa下,已知13.5g的Z单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的单质能与强酸、强碱溶液反应放出氢气 |
| W | W的一种核素的质量数为28,中子数为14 |
(2)X、Y、W气态氢化物的稳定性大小顺序H2O>CH4>SiH4(用化学式表示).
(3)写出Y单质的电子式
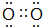 .
.(4)振荡下,向Z单质与盐酸反应后的无色溶液中逐滴滴加NaOH溶液直至过量,能观察到的现象是先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;W的单质与氢氟酸反应的化学方程式是Si+4HF=SiF4↑+2H2↑.
(5)在25℃、101kPa下,已知13.5g的Z单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
19.下列叙述正确的是( )
| A. | 合成高分子材料都难以降解,会造成环境污染 | |
| B. | 塑料、涂料和合成橡胶被称为“三大合成材料” | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯 | |
| D. | 用于生产“尿不湿”的高吸水性树脂属于功能高分子材料 |
 .
.