题目内容
12.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素为类铅元素.下面有关它的原子结构和性质预测正确的是( )| A. | 类铅元素原子的最外层电子数为7 | B. | 其常见价态为+2、+4、+6 | ||
| C. | 它的金属性比铅强 | D. | 它的原子半径比铅小 |
分析 原子序数为114的元素属于第七周期第ⅣA族,称为类铅元素,利用第ⅣA族元素的性质的相似性和递变性来解答.
解答 解:A.位于第ⅣA族,族序数等于最外层电子数,则类铅元素原子的最外层电子数为4,故A错误;
B.位于第ⅣA族,常见的价态为+2、+4,故B错误;
C.同主族从上到下金属性在增强,则它的金属性比铅强,故C正确;
D.同主族从上到下原子半径在增大,则它的原子半径比铅大,故D错误;
故选C.
点评 本题考查元素的位置及性质,熟悉第ⅣA族元素的性质是解答本题的关键,难度不大.

练习册系列答案
相关题目
2.X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
(1)W在元素周期表的位置是第三周期第ⅣA族;W的原子半径比X的大(填“大”或“小”).
(2)X、Y、W气态氢化物的稳定性大小顺序H2O>CH4>SiH4(用化学式表示).
(3)写出Y单质的电子式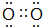 .
.
(4)振荡下,向Z单质与盐酸反应后的无色溶液中逐滴滴加NaOH溶液直至过量,能观察到的现象是先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;W的单质与氢氟酸反应的化学方程式是Si+4HF=SiF4↑+2H2↑.
(5)在25℃、101kPa下,已知13.5g的Z单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的单质能与强酸、强碱溶液反应放出氢气 |
| W | W的一种核素的质量数为28,中子数为14 |
(2)X、Y、W气态氢化物的稳定性大小顺序H2O>CH4>SiH4(用化学式表示).
(3)写出Y单质的电子式
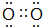 .
.(4)振荡下,向Z单质与盐酸反应后的无色溶液中逐滴滴加NaOH溶液直至过量,能观察到的现象是先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;W的单质与氢氟酸反应的化学方程式是Si+4HF=SiF4↑+2H2↑.
(5)在25℃、101kPa下,已知13.5g的Z单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
3.A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
(1)E在元素周期表中的位置第三周期第ⅥA族.
(2)B最简单气态氢化物的电子式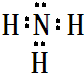 ,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式
,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式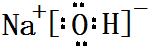 ,所含化学键类型:离子键、共价键.
,所含化学键类型:离子键、共价键.
(3)B、C、D、E简单离子半径由大到小顺序为:S2->N3->O2->Na+(填元素符号).
(4)用电子式表示E的氢化物的形成过程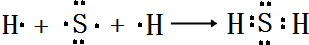 .
.
(5)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O.
(6)19.2g金属铜与一定浓度的B的最高价氧化物的水化物反应,产生标准状况下NO、NO2(不考虑N2O4的存在)混合气6.72L,则参加反应的HNO3的物质的量为0.9mol.
| 元素 | 元素性质或结构 |
| A | 最外层电子数是其内层电子数的2倍 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(2)B最简单气态氢化物的电子式
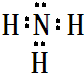 ,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式
,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式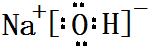 ,所含化学键类型:离子键、共价键.
,所含化学键类型:离子键、共价键.(3)B、C、D、E简单离子半径由大到小顺序为:S2->N3->O2->Na+(填元素符号).
(4)用电子式表示E的氢化物的形成过程
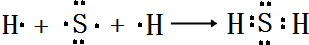 .
.(5)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O.
(6)19.2g金属铜与一定浓度的B的最高价氧化物的水化物反应,产生标准状况下NO、NO2(不考虑N2O4的存在)混合气6.72L,则参加反应的HNO3的物质的量为0.9mol.
20.下列各种叙述中,正确的是( )
①Cl-和Cl2的性质相同 ②ClO-具有氧化性 ③Cl-比Cl多一个电子 ④盐酸兼有酸性、氧化性、还原性 ⑤Cl-具有酸性 ⑥Cl2的氧化性比MnO2的强 ⑦Cl2只有氧化性而没有还原性.
①Cl-和Cl2的性质相同 ②ClO-具有氧化性 ③Cl-比Cl多一个电子 ④盐酸兼有酸性、氧化性、还原性 ⑤Cl-具有酸性 ⑥Cl2的氧化性比MnO2的强 ⑦Cl2只有氧化性而没有还原性.
| A. | ①②⑤⑥ | B. | 仅②④⑥ | C. | 仅②③④ | D. | ②③④⑥ |
7.下列变化不属于氮的固定的是( )
| A. | 根瘤菌把氮气转化为氨 | B. | 氮气和氢气在适宜条件下合成氨 | ||
| C. | 氮气和氧气在放电条件下合成NO | D. | 工业上用氨和二氧化碳合成尿素 |
17.某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究,实验过程如图,下列说法不正确的是( )

| A. | ①和②都是过滤操作 | |
| B. | 滤渣的成分是Cu和Fe的混合物 | |
| C. | 操作③和④都是在蒸发皿中进行 | |
| D. | 溶液B中反应的离子方程式:4Fe2++O2+8NH3+10H2O═8NH4++4Fe(OH)3↓ |
1.下列实验装置能达到相应实验目的是( )
| A. | 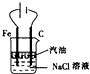 用如图装置制取Fe(OH)2沉淀 | |
| B. | 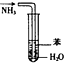 用如图装置吸收NH3,并防止倒吸 | |
| C. | 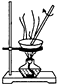 用如图装置蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 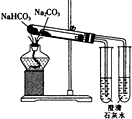 用如图装置比较Na2CO2与NaHCO3的稳定性 |
2.具有下列电子层结构的基态原子或离子,其对应元素一定属于同一周期的是( )
| A. | 两种原子的电子层上全部都是s电子 | |
| B. | 原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子 | |
| C. | 最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子 | |
| D. | 3p能级上只有一个空轨道的原子和3p能级上有一个未成对电子的原子 |
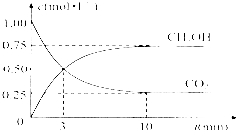 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.