题目内容
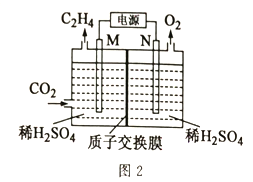
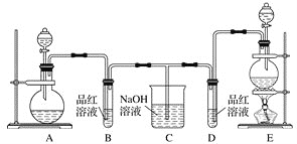
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4===Na2SO4+H2O+SO2↑
MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是________(填字母),反应中浓盐酸所表现出的化学性质是________________和________________。
(2)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,__________(填“B”或“D”)试管中无明显现象。
(3)装置C的作用是____________________。
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是__________________。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是____________________________。
【答案】E 还原性 酸性 D 吸收多余的二氧化硫和氯气 先变红,后褪色 SO2+Cl2+2H2O===2HCl+H2SO4
【解析】
(1)根据反应物的状态和反应条件选择反应装置,根据氯元素的化合价变化和生成物分析浓盐酸的性质;
(2)根据二氧化硫和次氯酸的漂白原理分析;
(3)根据二氧化硫和氯气均是大气污染物分析;
(4)根据氯水的性质分析;
(5)根据氯气能和二氧化硫在溶液中反应生成盐酸和硫酸解答。
(1)根据题给信息知,实验室制取氯气所用药品是固体和液体,反应条件是加热,所以应选用固液加热型装置,选E;实验室制取氯气的反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价降低,所以浓盐酸所表现出的性质是酸性和还原性;
MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价降低,所以浓盐酸所表现出的性质是酸性和还原性;
(2)氯气通入品红溶液中红色褪去,是利用次氯酸的强氧化性,生成的无色物质稳定,加热不复原;二氧化硫的漂白性是利用二氧化硫和有色物质化合生成无色物质,生成的无色物质不稳定,加热复原,因此D试管中无明显现象;
(3)氯气和二氧化硫均有毒不能直接排放到空气中,需进行尾气处理,装置C的作用是吸收多余的SO2和Cl2防止污染环境;
(4)氯气溶于水生成盐酸和次氯酸,氯水显酸性和强氧化性,因此若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是先变红,后褪色;
(5)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应生成盐酸和硫酸而使气体失去漂白性,反应方程式为Cl2+SO2+2H2O=H2SO4+2HCl。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】C、N、O、Na、Mg、Al、S、Cl是常见的八种元素,根据元素及其化合物性质,回答下列问题:
(1)S在周期表中的位置为______;CO2的电子式是_______。
(2)比较O、Na元素常见离子的半径大小(用化学式表示,下同)____>____;__________比较S、Cl元素的最高价氧化物对应水化物的酸性强弱:____>____ 。_______________
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
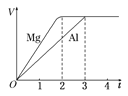
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的结构简式为______;Q的化学式为_______ 。
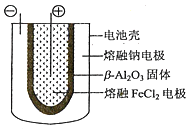
(5)熔融状态下,钠和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2![]() Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。