题目内容
【题目】一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是
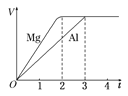
A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
【答案】D
【解析】
试题分析:Mg与盐酸反应方程式是:Mg+2H+=Mg2++H2↑,铝与盐酸反应的方程式是:2Al+6H+=2Al3++3H2↑.A.根据图像可知反应产生的氢气的体积相等,则根据n=V/Vm可知,氢气的物质的量相等。假设发生反应产生氢气的物质的量是3mol,则反应消耗的镁和铝的物质的量之比为3∶2 ,正确;B.在反应过程中产生的氢气物质的量相等,则转移电子的物质的量相等,所以镁和铝转移电子数之比为1∶1,正确;C.镁和铝的摩尔质量之比为24:27=8∶9,正确;D.根据图像可知镁和铝反应所用时间之比为2∶3,错误。

练习册系列答案
相关题目