题目内容
【题目】大气中CO2含量的增加会加剧温室效应,秉承“低碳环保,绿色出行”的生活理念,CO2的综合利用也成为热门研究领域。
I.CO2可用于生产乙烯。
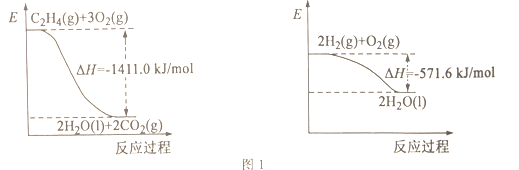
(1)依据图1写出CO2和H2生成C2H4和H2O(l)的热化学方程式________。
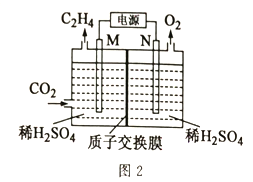
(2)以稀硫酸作电解质溶液,利用电解法将CO2转化为乙烯的装置如图2所示。M电极的电极反应式为_____,工作一段时间后,阳极室中溶液的pH_____(填“增大”“不变”或“减小”)。
Ⅱ.CO2与H2在一定条件下可生产二甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)Δ H<0
CH3OCH3(g)+3H2O(g)Δ H<0
(3)在2.0L恒容密闭容器中,加入2.0molCO2和6.0molH2,恒温条件下经过5min达到平衡状态,此时的压强是起始压强的2/3
①0~5min内反应的平均速率v(H2)=____,此温度下的平衡常数K=______.
②平衡常数K(800K)______K(900K)(填“>”“=”或“<”)
(4)分别以Cat.1和Cat.2作催化剂发生该反应,反应进行相同的时间后,测得CO2的转化率a(CO2)随反应温度T的变化情况如图3所示(忽略温度对催化剂活性的影响)。
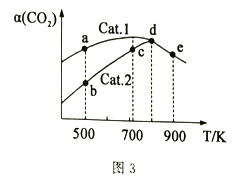
①该反应的活化能Ea(Cat.1)________Ea(Cat.2)(填“>”或“<”)。
②a、b、c、d、e五个状态中一定是平衡状态的是_______(填字母)。
【答案】 2CO2(g)+6H2(g) == C2H4(g)+4H2O(l) ΔH = -303.8 kJ/mol 2CO2 +12H+ +12e == C2H4 +4H2O 减小 0.4mol/(Lmin) 3.0 L4/mol4 > < d、e
【解析】I.(1)依据图1,分别写出热化学方程式:① C2H4(g)+3O2(g)==2CO2(g)+4H2O(l) ΔH = -1411.0 kJ/mol;②2H2(g)+O2(g)==2H2O(l) ΔH = -571.6 kJ/mol;根据盖斯定律,②×3-①得
2CO2(g)+6H2(g) == C2H4(g)+4H2O(l) ΔH = -303.8 kJ/mol 。故本题答案为:2CO2(g)+6H2(g) == C2H4(g)+4H2O(l) ΔH = -303.8 kJ/mol 。
CO2转化为乙烯,碳元素化合价降低,得电子被还原,发生还原反应。所以M电极的电极反应式为2CO2 +12H+ +12e == C2H4 +4H2O;因为阳极的电极反应为2H2O-4e-=O2↑+4H+,氢离子浓度增加,所以工作一段时间后,阳极室中溶液的pH减小。
Ⅱ.(3)设容器中转化的CO2的浓度为2x,
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
起始浓度(mol/L) 1 3 0 0
变化浓度(mol/L) 2x 6x x 3x
平衡浓度(mol/L) 1-2x 3-6x x 3x
依据题意,有(1-2x+3-6x+x+3x)/(1+3)=2/3,解得,x=1/3;
①0~5min内反应的平均速率v(H2)=![]() =0.4mol/(Lmin),
=0.4mol/(Lmin),
此温度下的平衡常数K=c(CH3OCH3)·c3(H2O)/c2(CO2)·c6(H2)=![]() L4/mol4 =3.0 L4/mol4
L4/mol4 =3.0 L4/mol4
②因为正反应为放热反应,升温平衡逆向移动,平衡常数减小,所以平衡常数K(800K)>K(900K);
(4)①从图3a,b点数值可知,Cat.1催化效率更高,反应更快,活化能更低,所以活化能Ea(Cat.1)<Ea(Cat.2);
②因为催化剂只能改变反应速率,不能使平衡发生移动,最终达到平衡时二氧化碳转化率应相同,所以a、b、c、d、e五个状态中一定是平衡状态只有d、e两点。

 阅读快车系列答案
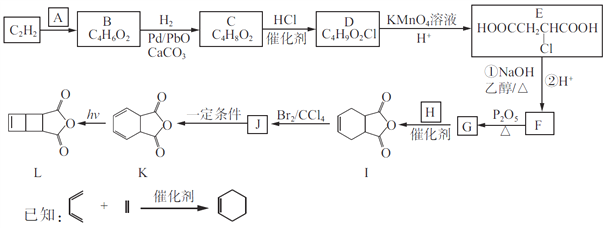
阅读快车系列答案【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
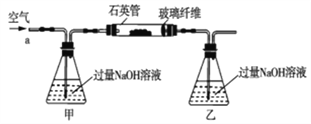
(实验一)测定硫元素的含量
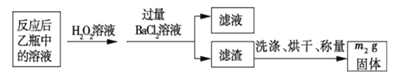
反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00mL稀释液,用0.100mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
第一次 | 第二次 | 第三次 | 第四次 | |
消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。